产品说明
3D组织器官芯片模型
SynBBB血脑屏障模型,SynTumor 3D肿瘤模型,SynTox 3D毒理模型,SynRAM 3D炎症模型,synvivo血管模型芯片,SynALI气液界面肺模型
一、SynALI基于气液界面肺模型
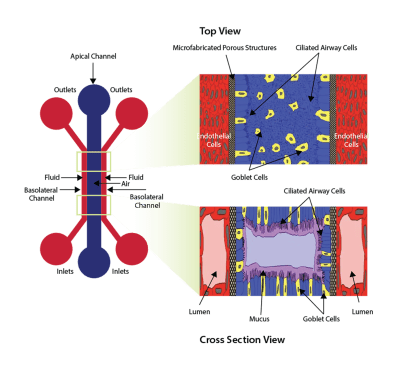
用于在内皮细胞和上皮细胞之间形成气液界面的设备示意图。 空气(或上皮)通道通过微制造的多孔结构与双流体(基底外侧)通道隔开。 右图显示从顶部和横截面视图看时细胞的定向。
SynALI是模仿肺结构的新型气液界面模型。该装置由一个塑料的,一次性的,光学透明的微流控芯片组成,该芯片被上皮细胞功能化,周围的血管系统由内皮细胞组成。 SynALI结构在气道细胞之间维持气液界面。结果,形成气管小管,其运输粘液并被周围的上皮维持。细胞形态,气道结构,细胞间相互作用以及气道功能(例如粘液运输,睫状跳动,治疗性改善)可以在正常和患病情况下实时可视化和量化。
du特功能包括:
●形态逼真的气道结构和环境
●穿过上皮和内皮的气液界面(ALI)
●体内血流动力学切应力
●实时可视化细胞和屏障功能,包括黏液,睫状跳动,免疫细胞相互作用和治疗性筛选
●稳健易用的协议
使用SynALI设备开发的模型示例:

肺泡肺模型具有人微血管肺内皮细胞和肺泡上皮I型和II型细胞。

小气道肺模型–与人支气管上皮细胞(HBEC)和肺微血管内皮细胞共培养。
产品购买选项
芯片:根据您的特定研究应用,您可以从IMN2线性芯片配置中选择。
试剂盒:运行SynALI分析所需的基本组件都可以作为试剂盒购买。 有两种格式:
入门套件:shou次购买时请选择
10个SynALI芯片-IMN2线性(3um缝)
配件,包括油管,夹具,针头和注射器
气动灌注装置(灌注管路以除去空气时需要)
检测试剂盒:如果您以前购买过气动灌注设备,请选择此试剂盒格式
10个SynALI芯片– IMN2 linear(3um缝)
配件,包括油管,夹具,针头和注射器
(套件不包括建立气液接口所需的气泵)
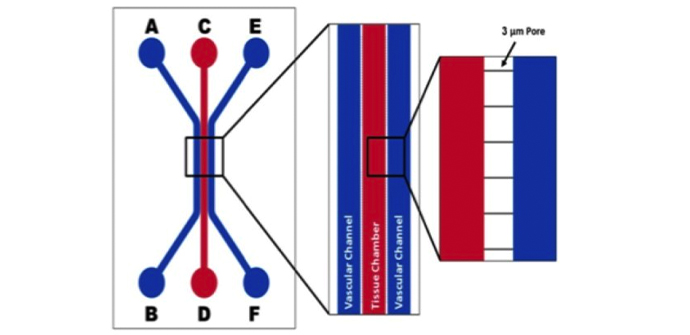
SynVivo平台用于创建人工片上呼吸道
来自阿拉巴马大学伯明翰分校的研究人员报告了SynVivo平台在开发人类片上气道模型中的应用。结合新颖的微光学相干断层扫描(?OCT),该模型可以对睫状运动进行wu创定量成像。成像包括搏动频率和粘膜纤毛转运。
这种微流体装置的优势在于,可以为气道上皮和相邻的内皮形成完整的管腔。 UAB医学院儿科肺病学家兼助理教授Jennifer Guimbellot博士说:“这是模型发展的一大,该模型概括了细胞的分化和组织成管状结构,类似于小气道和微脉管系统。”
气道模型是通过气液界面(ALI)将原代上皮细胞和内皮细胞共同培养而开发的。它是使用可实时定量成像的定制SynVivo微流体芯片创建的。通过在生理条件下监测活性纤毛,产生粘液的细胞和细胞功能的生物标志物,证明了已开发的气道上芯片模型的功能。
研究人员的验证
医学教授兼格雷戈里·弗莱明·詹姆斯囊性纤维化研究中心主任史蒂芬·罗博士说:“开发合适的模型来模拟人类完整的粘膜纤毛转运设备是一项重要的工作,对气道疾病的生物学研究具有重要意义包括囊性纤维化”。发达的气道模型代表了个性化医学的新方法,并作为药物开发的预测工具。
共培养气道微流模型,用于显微镜和微光学相干断层扫描成像
作者:刘忠裕,斯蒂芬·麦凯,迪伦·戈登,贾斯汀·安德森,达斯汀·W·海斯考克,查尔斯·加森,吉列尔莫·特尔尼,乔治·所罗门,卡皮尔·潘特,巴拉巴斯卡·普拉巴哈卡潘迪安,史蒂文·罗维和珍妮弗·吉姆贝洛特。
生物医学光学快报弟10期,弟5414-5430页(2019)。
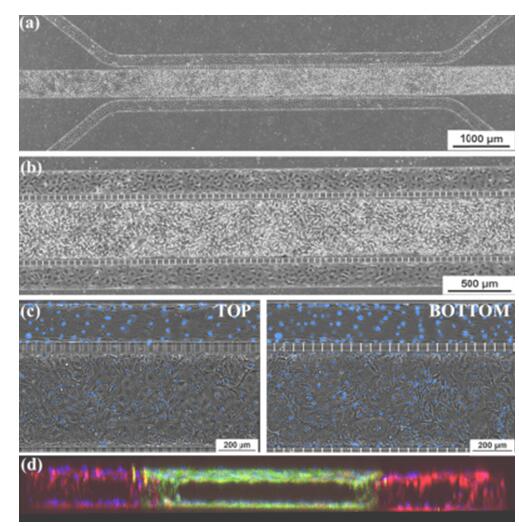
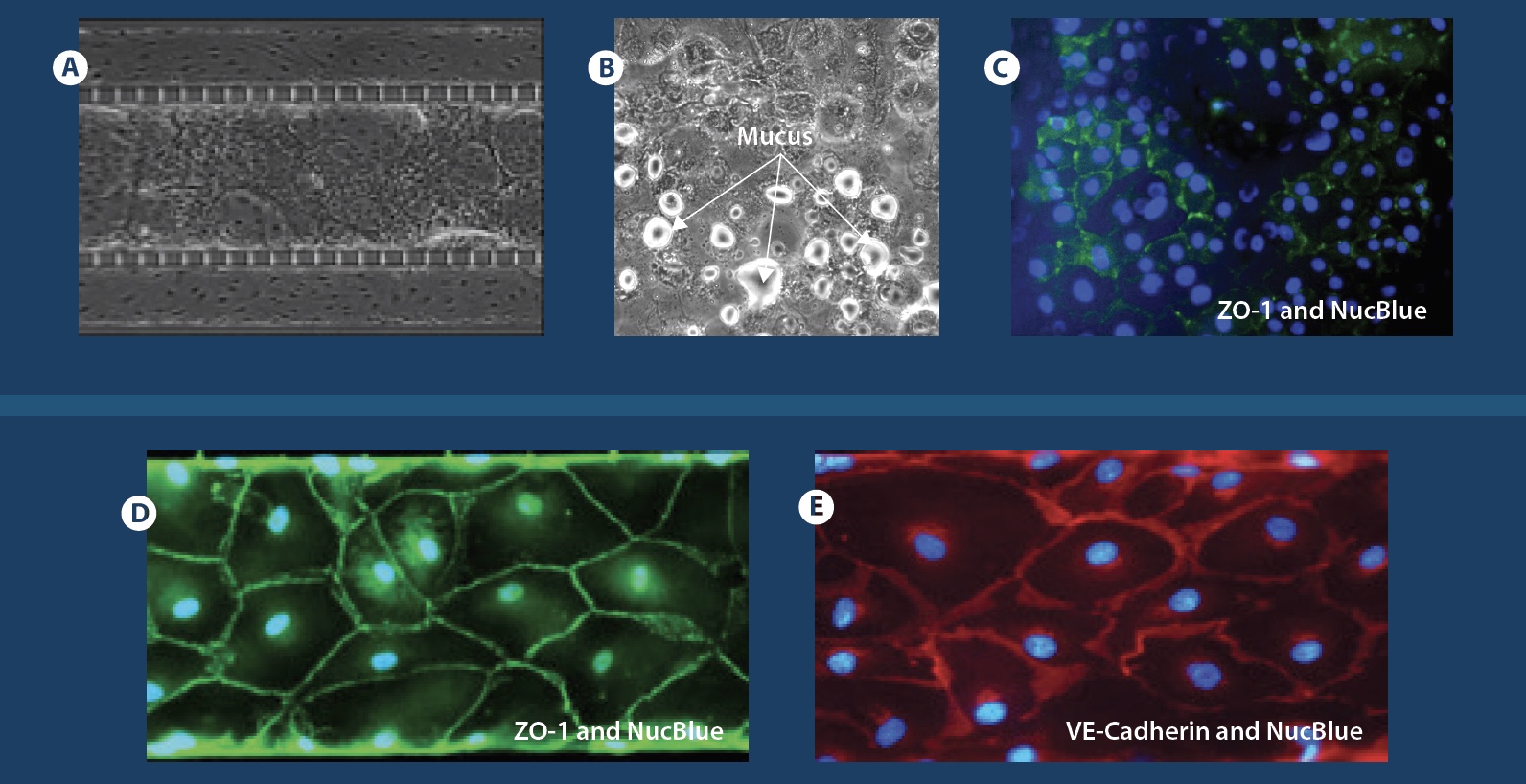
微流控芯片中的上皮和内皮共培养。 (a)和(b)融合共培养芯片的相衬图像,中心通道上皮细胞,周围通道内衬内皮细胞。 (c)通道顶部和底部的相衬,显示组织和血管通道中汇合的单层。 这些图像显示了中央通道顶部和底部以及一侧通道的细胞汇合处的中央透明管腔。 (d)共培养芯片的3-D重建共聚焦横截面图像,显示了三个通道中的管腔形成(10倍放大)。 摘自Liu et al 2019。
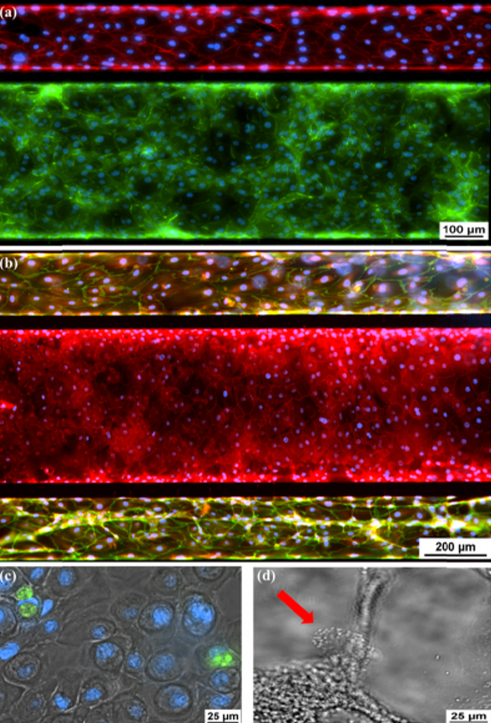
分化的上皮细胞和内皮细胞的免疫荧光。 (a)Ecadherin(绿色),上皮细胞粘附素蛋白。 VE-钙黏着蛋白(红色),内皮细胞黏附蛋白。 (b)ZO-1(红色)染色中央通道上皮细胞的紧密连接,以及血管通道的VE-钙黏着蛋白染色(绿色)。 (c)Muc5ac(绿色),上皮细胞内部的细胞内粘蛋白染色。 (d)有红色箭头指示的纤毛上皮细胞。
Small Airway Lung Model Exhibits Mucus Formation and Biomarker Staining
A-C Confluent co-culture of lung endothelial and epithelial cells following ALI development highlighting mucus formation and staining of biomarkers in epithelial cells. D-E Biomarker staining for tight junction markers (VE-Cadherin and ZO-1) in endothelial cells.
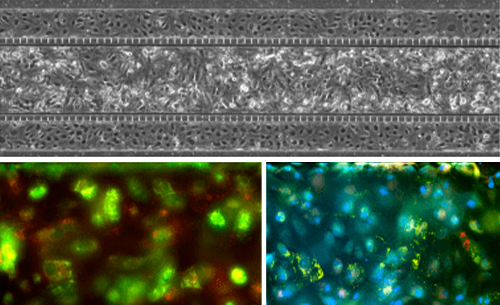
Alveolar Lung Model: Co-Culture and Tri-Culture Options
Co-Culture with biomarker staining
Top image shows lung microvascular endothelial and epithelial cell co-culture in the SynALI devices. Bottom images: Red: Type I Cells: HT_56 antibody. Green: Type 2 Cells: HT_280 antibody. Blue: Nuclei
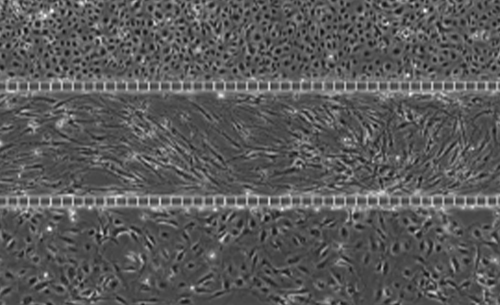
Tri-culture with Lung Endothelial Cells, Fibroblasts, Epithelial Cells
Phase images of SynALI Alveolar model tri-culture: Top channel: Lung microvascular Endothelial cells. Middle channel: Lung Fibroblasts. Bottom channel: Lung Epithelial cells.
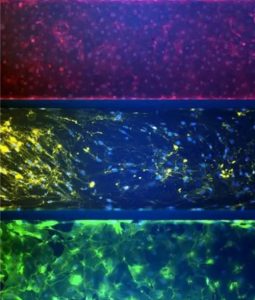
Biomarker Staining
Triculture Alveolar lung model showing biomarker staining – VE-Cadherin and Nuc Blue in lung endothelial cells, Lung Fibroblast Surface protein and Nuc Blue in the middle fibroblast layer and E-Cadherin, and Nuc Blue in the epithelial cell (bottom)
Long Term Tri-Culture and Mucus Secretion
Alveolar Lung Model: Left image shows culture over weeks1 through week 6. Mucus secretion is shown on the right.
Assay Development and Screening using SynALI:
-
Monoculture using primary epithelial cells
-
Co-Culture with endothelial cells
-
Tri-culture with fibroblasts
-
Toxicity assays
-
Biomarker analysis
-
Therapeutic screening
Endpoints to choose from:
Vascular permeability using fluorescent-tagged molecule, ROS, biomarkers, collect cells or effluents for downstream genomic, proteomic, or transcriptomic analysis
|