G-Rex悬浮细胞培养系统-T细胞

G-Rex悬浮细胞培养系统使用特点:
★ 一次性加入培养基,培养10天,细胞扩增100倍。不需要反复换液和操作细胞
★ 静置培养,普通的培养箱即可进行
★ 培养瓶与仪器配合,以半自动方式进行细胞回收
★ 生产CAR-T细胞与传统方法相比表达CD62L和CD25的比例更高,抗肿瘤活性更强
★ 封闭系统,满足GMP生产要求
G-Rex透气型培养容器截面说明图:
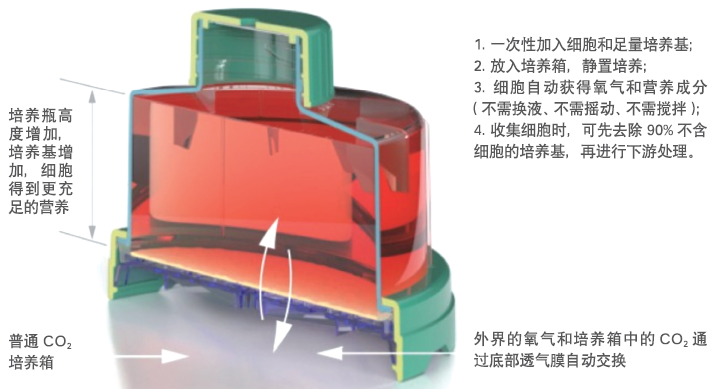
系统组成:
1、GatheRex 细胞回收控制器

2、G-Rex培养容器

订货信息:
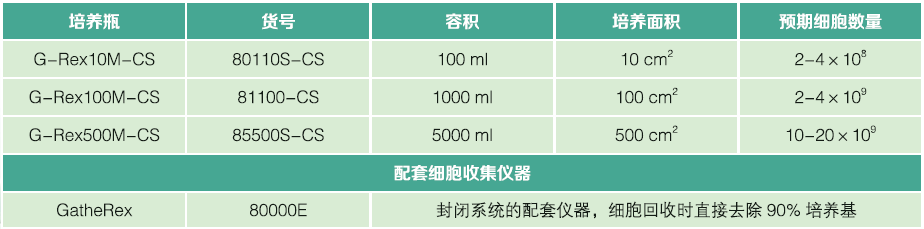
开放式培养瓶-用于CAR-T细胞优化培养条件及小规模扩增
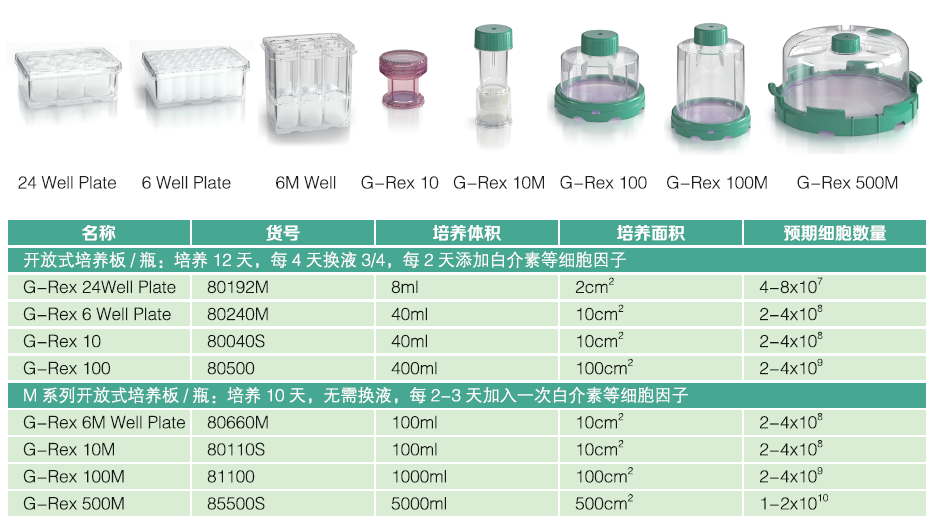
备注:终获得的细胞数量与培养面积相关,培养面积相同的培养瓶,终获得的细胞数量是类似的。
其他应用,已经证实在如下细胞培养中非常有效:
※ 免疫细胞培养(抗原特异性T细胞、EBV-CTL、TL、NK、Treg、HSC、LCL、K562等的研究和临床生产)
※ 单克隆抗体和重组抗体生产(杂交瘤、CHO、293等)
※ 胰岛运输(多至4000IE/cm2)
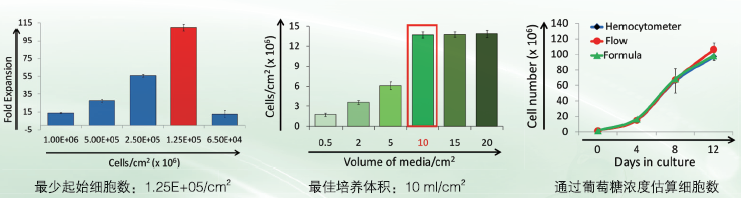
初始培养条件推荐:
应用文献参考:
一、CAR-T(嵌合抗原受体修饰的T细胞)的制备
Molecular Therapy vol.22 no.3,623-633 mar.2014
Knetics of Tumor Destruction by Chineric Antigen Receptor-modified T Ces(CAR-T细胞破坏肿瘤的动力学研究)
作者:Usanarat Anurathapan1,et al,Juan F Vera1
单位:1Center for Cell and Gene Therapy,Baylor Colege of Medicine,Texas Children's Hospital,and Houston
Methodist Hospital,Houston,Texas,USA.
摘要:
CAR-T细胞作为血液恶性肿瘤和实体肿瘤的治疗手段的应用越来越广泛。然而,在输入T细胞靶向单一肿瘤相关的抗原产品的压力下会导致靶抗原调节,造成肿瘤免疫逃逸。为了防止这种现象的发生,我们研究了同时靶向两种不同的抗原对肿痛细胞的影响。namely mucin 1和prostate stem ce两种抗原在包括胰腺癌和前列腺癌在内的多种实体肿瘤中表达。单du使用时,任何一种肿瘤抗原和CAR-T细胞的结合都能杀死肿瘤细胞,但肿瘤的异质性会导致免疫逃逸。我们结合了两种抗原识别的方法来显示更好的抗肿瘤效果,但这仍然不足以达到wanquan缓解(CR)。为了了解肿瘤逃逸的机制,我们研究了T细胞杀伤的动力学,发现肿瘤破坏的程度不仅取决于靶抗原的存在,还取决于靶抗原表达的强度。而这一特征可以通过epigenetic modulator上调靶标的表达,和增强CAR-T细胞的杀伤力来改变。
简要实验方法:
T细胞的病毒转导:将表达CAR-MUC2或CAR-PSCA的逆转录病毒在24孔板中感染。CAR-T细胞的快速扩增使用G-REX 100M培养瓶,直接加入1L含50U/ml IL-2的培养基进行扩增。
实验结果:

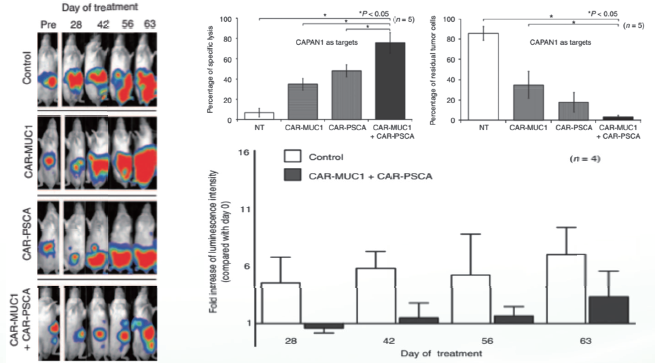
针对不同靶点的CAR-T细胞治疗效果:由于肿瘤存在异质性,针对单一靶点会产生肿瘤免疫逃逸。而结合了两种抗原识别的CAR-T细胞,拥有更强的抗肿瘤活性
摘要:
An Opimzed frocess of Generating CAR-T Cells for Cinical Applications
Pradip Bajgain1,et al,Juan F.Vera 1.
使用G-Rax100M扩端CAR-PSCA T细胞,初给细胞数25E+6,一次性加入1L培养基,每周加入3次IL2,终得到细胞数2963.8±195.2E+6。
使用G-Rex生产的CAR-T细胞与传统方法培养20天相比表达CD62L和CD25的比例更高,抗肿瘤活性更强。
二、TCR-T细胞的制备
JTransl Med (2018) 16:13
Erhanced ctinical-scale manutactuing of TCR rnsduced T-cels using closed cuture systen modues(使用封闭式系统加速临床级别TCR-T细胞的生产)
作者:Jianjan Jin1,et al,David F.Stroncek1 and Steven L.Highfl
单位:1Center or Celular Engineering. Departnment of Tanstuslon Medcne, Cintcal Center,Natonal hstutes of
Health,USA
摘要:
背景:用于表达特异性T细胞受体(TCR)的T细胞的基因工程已经成为治疗各种恶性肿瘤的新策略。由于缺乏能够扩增足够数量的T细胞用于临床的封闭培养系统,使得这些类型的疗法的广泛使用受到一定程度的限制。在这里,我们评估了一个强大的临床级制造TCR基因工程工细胞的过程。
方法:对人乳头瘤病毒E6和E7的TCR进行了du立测试。21天的过程分为一个转导期(7天)和一个快速扩增期(14天)。用两份健康的供体样本和四份上皮癌患者的样本对这一过程进行了评估。
结果:该过程使活的有核细胞增加了2000倍,并且转导效率高(64%-92%)。在培养结束时,功能测定表明这些细胞有效而特异的杀伤肿瘤组胞的能力,并分泌大量的干扰素和肿瘤坏死因子。培养的两个阶段采用了封闭或半封闭的模块,包括一阶段的自动密度梯度分离和细胞培养袋以及弟二阶段的封闭的G-Rex培养装置和洗涤/浓缩系统。
结论:使用模块化系统和半自动设备,可以大规模的制造高活性的临床级TCR转导的T细胞。该过程目前正在NIH临床中心和一些进行中的临床试验中使用,并可用于其他使用封闭系统扩大和优化其生产过程的细胞治疗制造场所。
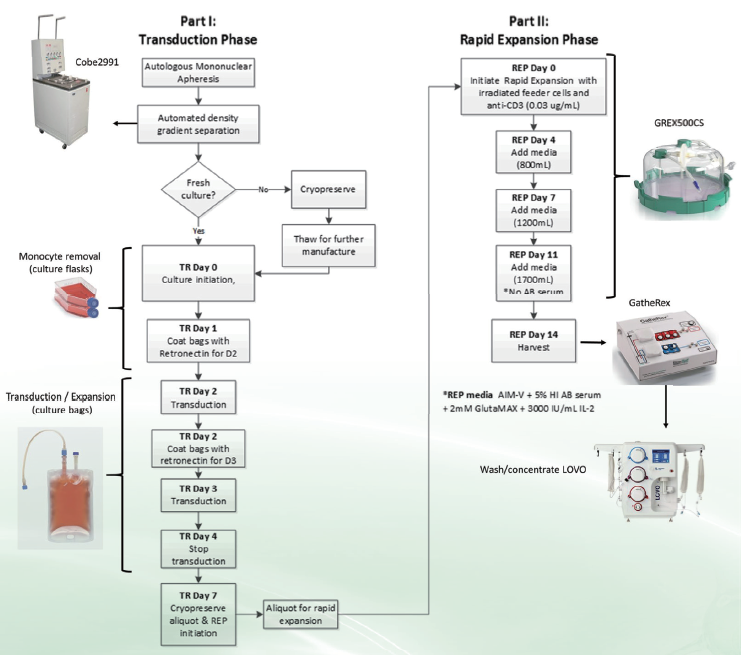
生产流程图。
此图概括了E6 TCR-和E7 TCR-特异性T细胞的制造方案。一阶段(左)概述了培养物的转导阶段,并延续至弟7天。在培养阶段结束时,细胞可以冷冻保存,或者进入弟二阶段(培养物的快速扩增阶段)。在这一阶段,TCR转导的T细胞与来自三个不同供体的同种异体饲养细胞混合,并在封闭的G-REX500培养装置中扩增14天。
三、TIL(肿瘤浸润淋巴细胞)的制备
JImmunother.2012 April:35(3):283-292
Simplified Method ol tho Growth of Human Tumor Infilrating Lymphootes (TIL)in Gas-Permeable Flasks to Numbers Needed for Pationt Treatment(使用透气型培养瓶将TIL细胞培养至病人治疗所需细胞数的筒单方法)
作者:Jianjian Jin1,et al,Steven A. Rosonberg2
单位:1Cell Processing Section,Department of Transfuslon Medicine,Clinical Center,National Institutes of
Heatth Bothesda,Maryland,USA 2Surgery Branch,Natonal Cancer Instituto,National Institutos of Heath,Bothesda,
Maryland,USA 3Wlson Wolf Manutacturing.New Bnghton,MN,USA
摘要:使用自体肿瘤浸润肿瘤T淋巴细胞治疗恶性黑色素瘤的临床效果很好。但TIL细胞的制备过程非常困难。在此,我们使用一种透气型培养瓶建立了快速扩增TIL细胞的简单方法。shou先在G-Rex10中培养从肿瘤消化液和肿瘤碎片得到的TIL细胞,接下来使用能容纳500ml培养基的G-REX100进行快速的扩增培养。来源于14位患者中13个的肿瘤消化液和quan步11个肿痛碎片的TIL细胞,在G-Rex10中成功完成了初始生长。然后将得到的TIL细胞接种5×106TIL到G-Rex100中,生长7天后分至3个G-Rex100。经过2次快速扩增,细胞可扩增成8-10×109,先将的TIL接种烧瓶中,为了获得用于患者治疗的30-60×109组胞,我们用接种6只G-Rex100(5x106细胞/瓶),扩增成18个G-Rex100。用G-REX大规模培养TIL细胞,快速扩增大约需要9-10升培养基,大约只有其做方法的1/3-1/4。
流程简介:
TIL的初始培养:将病人的肿瘤组织切成小块(1-8mm),加入酶消化(RPMI 1640.2mM Glutmax.10 u g/mL庆大霉素30 units/mL. Dnase和1.0 mg/mL胶原酶),同时使用机械法进行组织分离。组织块加入消化液后立即机械分离1分钟、然后放入孵箱孵育30分钟,再次机械分离1分钟。再放入孵箱继续孵育30分钟,然后进行弟三次机械分离。如果弟三次分离之后仍有大块组织存在,可以再进行1-2轮处理。如果终产物中有大量红细胞或死细跑,可进行密度梯度离心去除。
分离得到的细胞取10-40×106细胞加入40ml培养基,加入G-REX10培养瓶中进行培养。24孔板与G-REX10都放入孵箱,弟2-3天换半液,培养至弟五天。然后组胞转至G-REX100。
TIL的快速扩端培养:
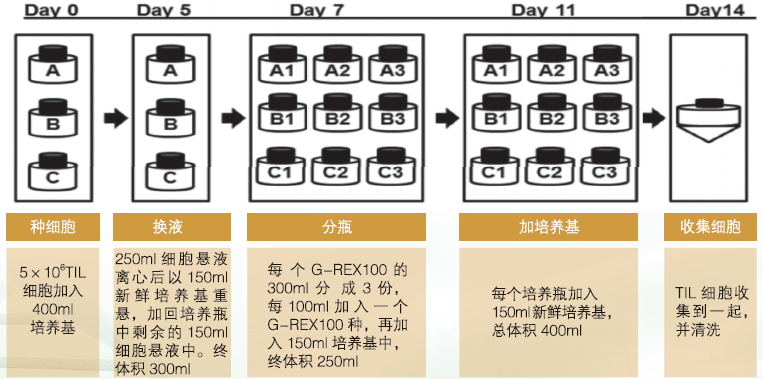
实验结论:总体来说,与24孔板加普通培养瓶和培养袋的流程相比,用透气型G-REX培养瓶进行TIL的起始培养与后续快速扩增,需要的耗材更少,需要的培养基更少,需要的培养箱空间更少,需要的操作更少。使用G-REX培养瓶,将使大多数实验室能大批量培养TIL用于临床治疗。
四、CTL(抗原特异性T淋巴细胞)的制备过程
JImmunother.2010 April:33(3):305-315
Accelerated production of antigen-specic T-cells for pre-clinical and clinical applications using Gas-
permeable Rapid Expansion culture ware(G-Rex)(使用G-REX加速抗原特异性T细胞的生产过程以进行临床前和临床应用)
作者:Juan F.Vera,et. al.
单位:Center for Cell and Gene Therapy,Departments of Pediatrics,Immunology,Medicine,Virology,Baylor
College of Medicine,The Methodist Hospital and Texas Children's Hospital
摘要:用于过继免疫治疗的抗原特异性细胞毒性T淋巴细胞(CTL)的大量制备,由于受到其预期功能和特异性的限制是非常复杂和花费时间的。其培养的条件非常苛刻,有时只能在2cm2的孔中实现培养,但会受到气体交换、营养物质和废物积累的限制。为克服这些困难而采用的一些生物反应器复杂而昂贵,并且有时细跑生长的效果不佳。本研究发现抗原特异性CTL在经过刺激后会经历7-10次分裂。但是预期的CTL扩增倍数只有在培养的一周能达到。通过重复一周时的培养条件,我们能够让CTL细胞扩增至预期的水平,这一水平能维持数周而不影响细胞表型和功能。但是所需24孔板的数量非常多,并且需要频繁的更换培养基,从而增加了实验的复杂性和生产成本。因此,本研究评估了一种新型的适气型培养装置(G-REX),该装置通过底部的硅胶膜通透空气,使得细胞生长不受培养基深度的限制。
实验方法及结果:

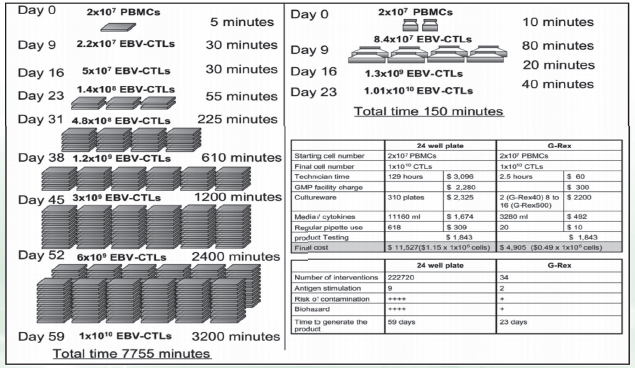
实验结论:G-Rex系统能够有效的支持CTL细胞的扩增,终可以增加高达20倍的产量,但所需的技术人员的时间却大大下降。重要的是,在此装置中的细胞扩增不是因为细胞分裂的多,而是因为细胞死的少。因此这一装置能增加T细胞产量,降低CTL生产时的复杂性和费用。可以使细胞疗法更易接受。
五、NK(自然杀伤细胞)的制备
Cytotherapy,2012;14:1131-1143
Large-scale ex viwo expansion and characterization of natural killer cells- for clinical applications(大批量体外扩增和鉴定NK细胞用于临床治疗)
作者:Natalia Lapteva1,et al.
单位:1Center for Cell and Gene Therapy.The Methodist Hospital,Texas Children's Hospital,Houston,TX and
2Department of Pediatrics,Baylor Colege of Medicine,Houston,Texas,USA,3National University of Singapore,
Singapore,and 4University of Arkansas Medical Center,Litle Rock,Arkansas,USA
摘要:
背景及目的:纯化和大批量扩增临床级别细胞的新方法使以NK细胞为基础的免疫疗法又引起人们的兴趣。
方法:我们成功的将之前发表的,使用表达1L-15和4-1BBL的K562细胞扩增NK细胞的方法,用新型的透气型静止培养瓶(G-REX)进行了改进。
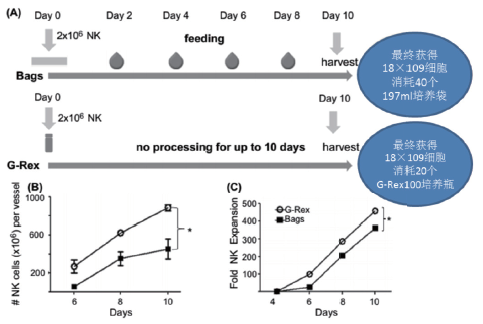
结果:使用这一新的系统,我们从15×107个CD3-CD56+NK细胞开始,在8-10天时间内,制备了高达19×109具备功能的NK细胞。G-REX与传统透气袋相比,扩增NK细胞的倍数更高,培养过程中不需换液或操作细胞。我们也发现在NK细胞上清刺激的情况下,K562-mb15-41BBL细胞能上调了细胞表面HLA1|型抗原的表达,这一细胞能刺激NK细胞中自体反应性CD8+T细胞。但是这些CD3+T经胞使用CliniMACS系统成功去除。我们优化的NK细胞冻存方法使NK细胞冻存12个月后依然有活力和功能。
结论:我们成功建立了使用透气型G-REX静止培养并大量扩增NK细胞的方法,符合GMP标准。这一方法能用于制备NK细胞进行癌症免疫治疗。
优点:
※ 同样培养时间,细胞增殖更快
※ 每个G-REX一次性加入400ml培养基,培养过程中wu需换液,wu需再续培养基
※ 操作少,减少污染的风险
※ 静置培养,在普通的培养箱放置即可
※ 细胞回收时可以先弃去大部分培养基再离心(1000ml vs.8000ml),操作更简单。