了解 Zhan 及其同事如何使用微流体和 DNA 纳米技术为合成细胞构建功能性细胞骨架。
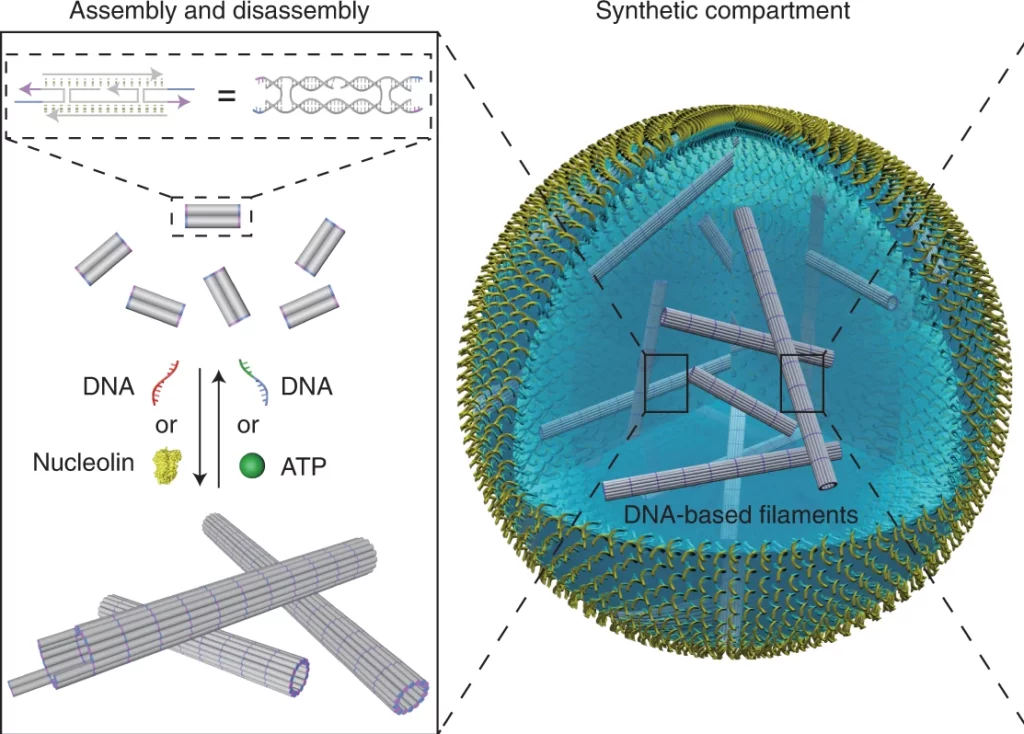
本研究摘要描述了 Pengfei Zhan、Kevin Jahnke、Na Liu和Kerstin G?pfrich 如何在细胞大小的微流控系统中使用 DNA 纳米技术构建合成功能性细胞骨架。
他们的工作zui近发表在 《自然化学》上,并展示了自下而上构建合成细胞的可喜成果。
摘要
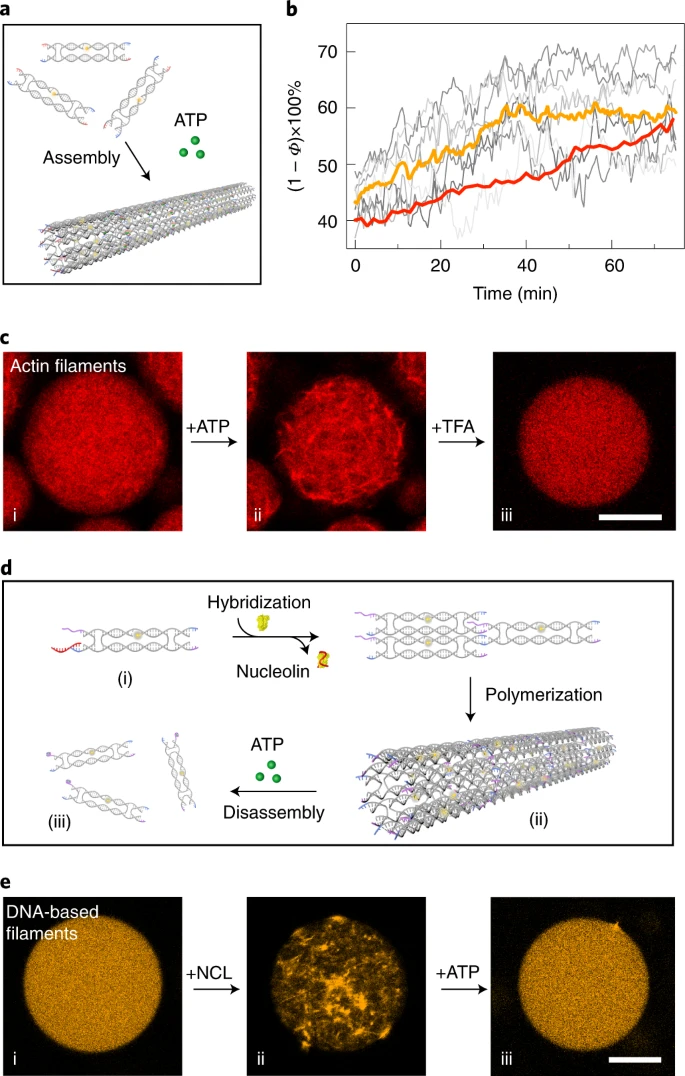
细胞骨架控制形状、内部组织、货物运输和其他基本细胞功能。模仿天然细胞骨架的这些特征是设计功能性合成细胞的关键。Zhan 及其同事使用 DNA 纳米技术和微流控技术构建了一个合成细胞大小的功能性 DNA 细胞骨架系统。该系统由自组装成在微流体隔间中运行的细丝网络的 DNA 瓦片组成。他们的人工细胞骨架显示出其天然对应物的特征,例如 ATP 触发的聚合和可逆组装。此外,他们的结果表明货物沿着 DNA 细丝进行自主运输。总体而言,这项工作突出了 DNA 纳米技术和微流体在自下而上构建合成细胞方面的巨大潜力。
简介 | 合成细胞的细胞骨架结构
细胞骨架由从细胞核延伸到细胞膜的相互连接的蛋白质细丝的动态细胞质网络组成。它提供机械支持,控制细胞形状,并参与信号转导和分子的细胞内运输。
设计细胞骨架以执行这些多样化和重要的功能对于自下而上创建wu细胞合成细胞至关重要。然而,尽管 DNA 纳米技术发展迅速,但构建多功能细胞骨架仍然具有挑战性。
在本文中,詹及其同事描述了他们如何设计一种在细胞大小的微流体隔间中运行的基于 DNA 的细胞骨架。它们的合成细胞骨架在基本功能方面模仿了它们的天然对应物,例如区室化、ATP 触发的聚合和可逆组装。他们的数据还表明细胞内货物运输是细胞生理学的关键过程。
目标
- 使用 DNA 纳米技术在微流体隔室中构建功能性基于 DNA 的细胞骨架。
- 掌握细胞骨架功能所需的复杂性,这是迈向wu细胞合成细胞结构的关键一步。
实验设置 | DNA 灯丝设计和封装
从预先确定的序列合成基于 DNA 的细丝,在基于 Tris-EDTA 的缓冲液中混合,并在热循环仪中退火。DNA 细丝通过透射电子显微镜 (TEM) 和原子力显微镜 (AFM) 可视化。
DNA 瓦片自组装成细丝网络,并封装在由OB1 流量控制器和 PDMS 芯片产生的表面活性剂稳定的油包水液滴中。油相 (1.4vol%) 在于将基于 PEG 的含氟表面活性剂溶解在 HFE 7500 油中。由于 OB1 流量控制器几乎可以为系统提供任何流量和压力曲线,因此它是液滴形成和颗粒封装的里想选择。
待封装的内容物在不同条件下悬浮在水相中:
- 对于用 ATP 功能化的 DNA 瓦片的聚合:将ATP 敏感瓦片(在含有 Mg2+ 的缓冲液中)与 10 mM ATP 混合,并使用微流体封装成液滴。
- 对于 DNA 瓦片的组装和拆卸:为了拆卸,将 DNA 细丝和 ATP 混合,将用于(去)聚合的 10μM 侵入链添加到溶液中,然后立即进行微流体液滴封装。在微流体封装之前添加 37.5?M 抗入侵者链,导致 DNA 细丝重新组装在一起。
- 对于肌动蛋白封装:肌动蛋白单体用 20?L AB DTT DD(双密度)缓冲液和 3.3?L 罗丹明-鬼笔环肽 (13U) 进行标记,然后使用微流体立即进行液滴封装,并在聚合过程中成像。
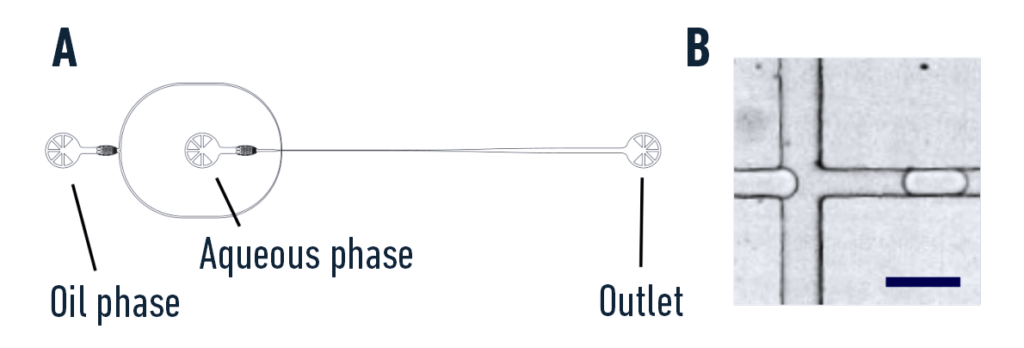
油相和水相均通过 0.4×0.9mm 聚四氟乙烯管注入 PDMS 芯片通道。连接到微流体装置的倒置显微镜用于观察液滴形成和封装过程(图 1)。
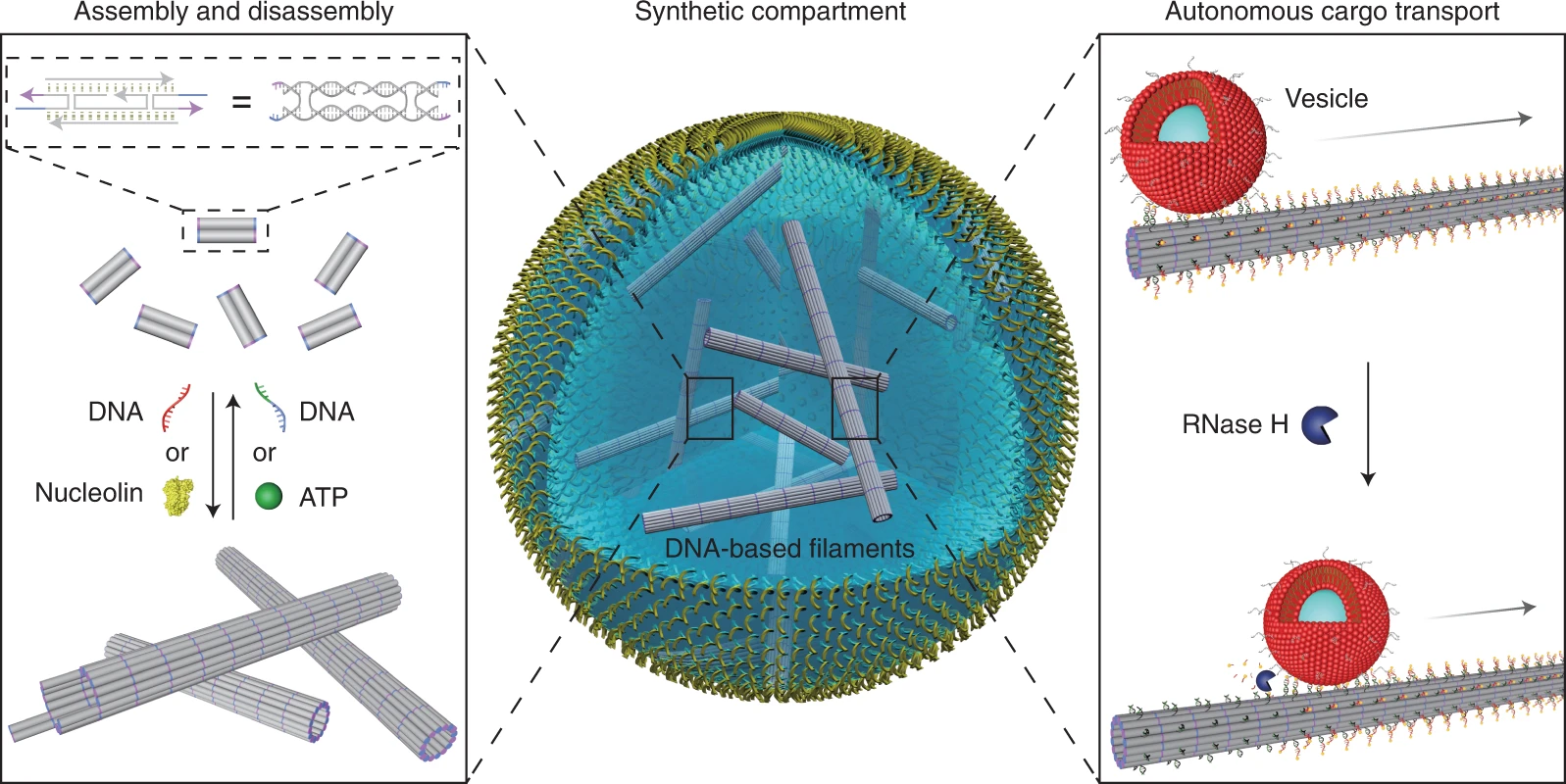
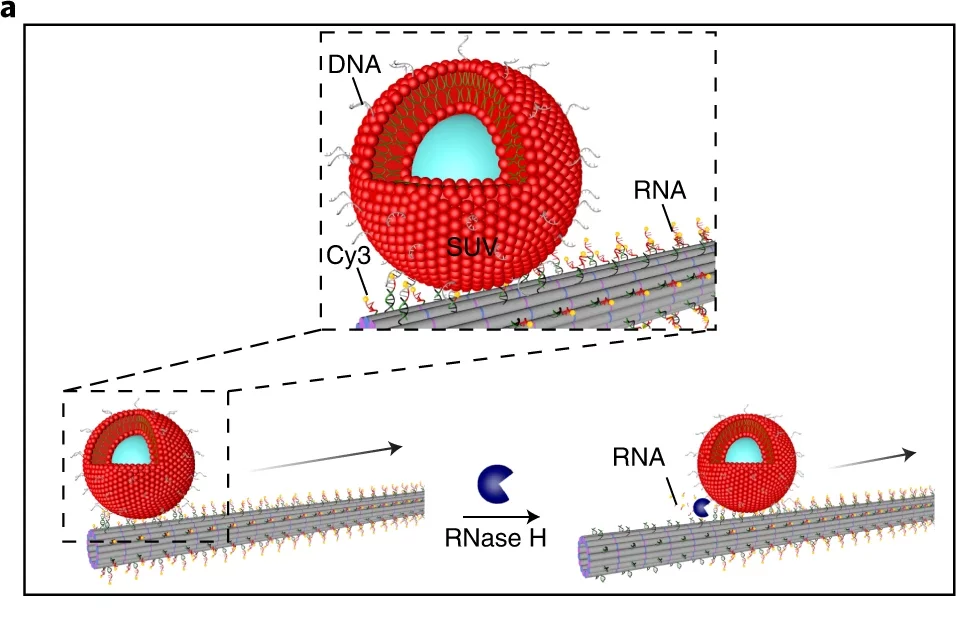
为了模拟细胞骨架运动蛋白沿微管的主动囊泡转运,将 RNA 突出端添加到 DNA 细丝中作为转运轨道。金纳米颗粒用作wu机货物,小单层囊泡 (SUV) 用作有机颗粒,两种类型的颗粒都附着在与 RNA 突出端匹配的互补 DNA 序列上。
材料
- OB1 压力控制器
- PDMS – 芯片(Sylgard 184,道康宁)
- PEG 基含氟表面活性剂(Ran Biotechnologies)
- HFE-7500油(杜邦)
- 聚四氟乙烯管(Bola)
- Axio Vert.A1(卡尔蔡司)
- DNA 链(Sigma-Aldrich)(DNA 序列可在论文的补充数据中找到)
- RNA-DNA 共轭链(Integrated DNA Technologies)
- Tris-EDTA 缓冲液(见论文)
- 共聚焦荧光显微镜 LSM 880 或 LSM 900 (Carl Zeiss)
- AFM(分子成像,布鲁克技术)
- 有关设备、计算、解决方案和缓冲液的更多详细信息,请参阅本文。
主要发现 | 基于 DNA 的细胞骨架结构和功能
Zhan 及其同事成功设计了一个细胞大小的微流体系统,该系统由多功能 DNA 瓦片组成,这些瓦片在油包水液滴内进行动态组装和拆卸。
合成细胞骨架设计
每个 DNA 瓦片包含五个 DNA 链,形成一个微米长的空心 DNA 管,具有四个粘性末端,用作结合域并形成管状 DNA 细丝(图 2)。
他们的观察还表明脂质囊泡或金纳米颗粒沿着合成细胞骨架的细丝自主运输。核糖核酸酶 H (RNase H) 介导的水解促进了所谓的脂质膜囊泡或金纳米颗粒沿细丝的引导运输(图 2)。
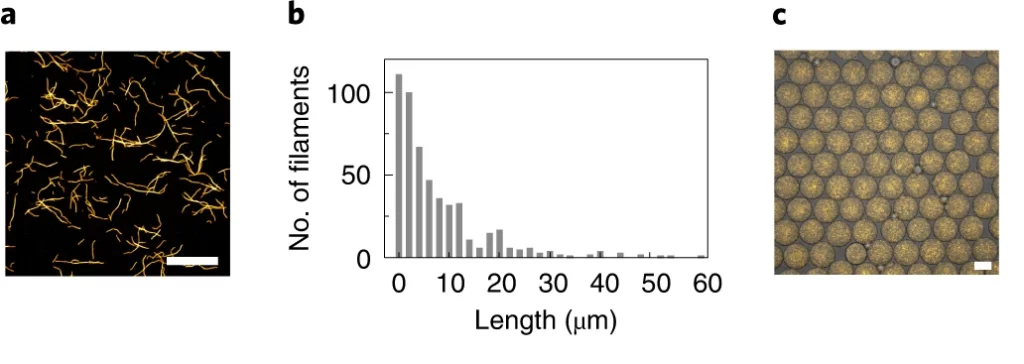
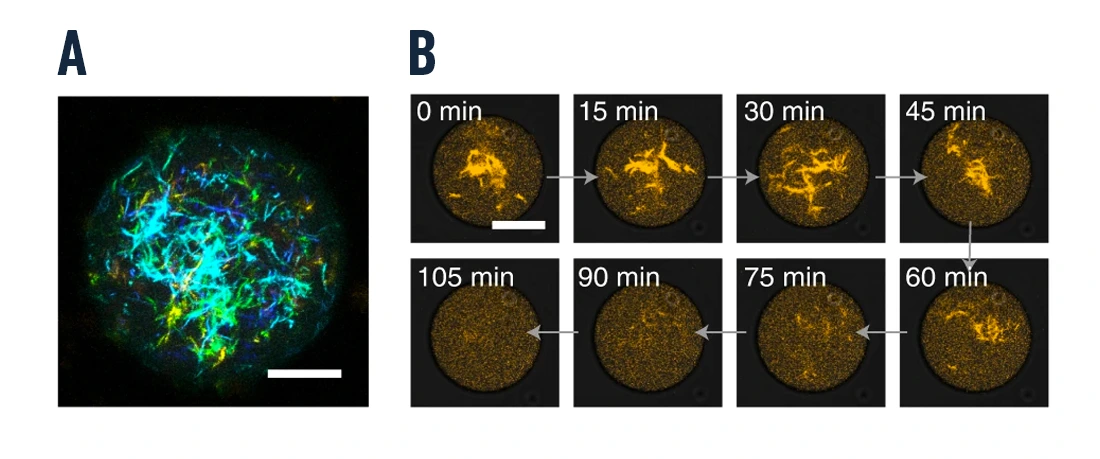
共聚焦显微镜显示含有组装的 DNA 细丝的单分散液滴。图 3 和视频 1 证实了油包水滴内 DNA 细丝的活力和不断重排。
DNA细丝组装和拆卸
DNA 瓦片由双响应 DNA 细丝可逆地分解,该 DNA 细丝包含触发组装的 NCL 特异性适体和触发分解的 ATP 特异性适体。通过共聚焦显微镜对液滴内的这种动态聚合过程进行了量化(图 4 和视频 2)。
沿 DNA 细丝运输
细胞微管中的细胞骨架运动蛋白负责主动的囊泡运输,这是细胞生理学中的重要角色。为了模仿这一特征,詹和同事设计了带有 RNA 突出端的 DNA 细丝,以沿着 DNA 链运输货物。小单层囊泡 (SUV) 充当有机货物,而金纳米粒子提供了对wu机粒子运输的洞察。
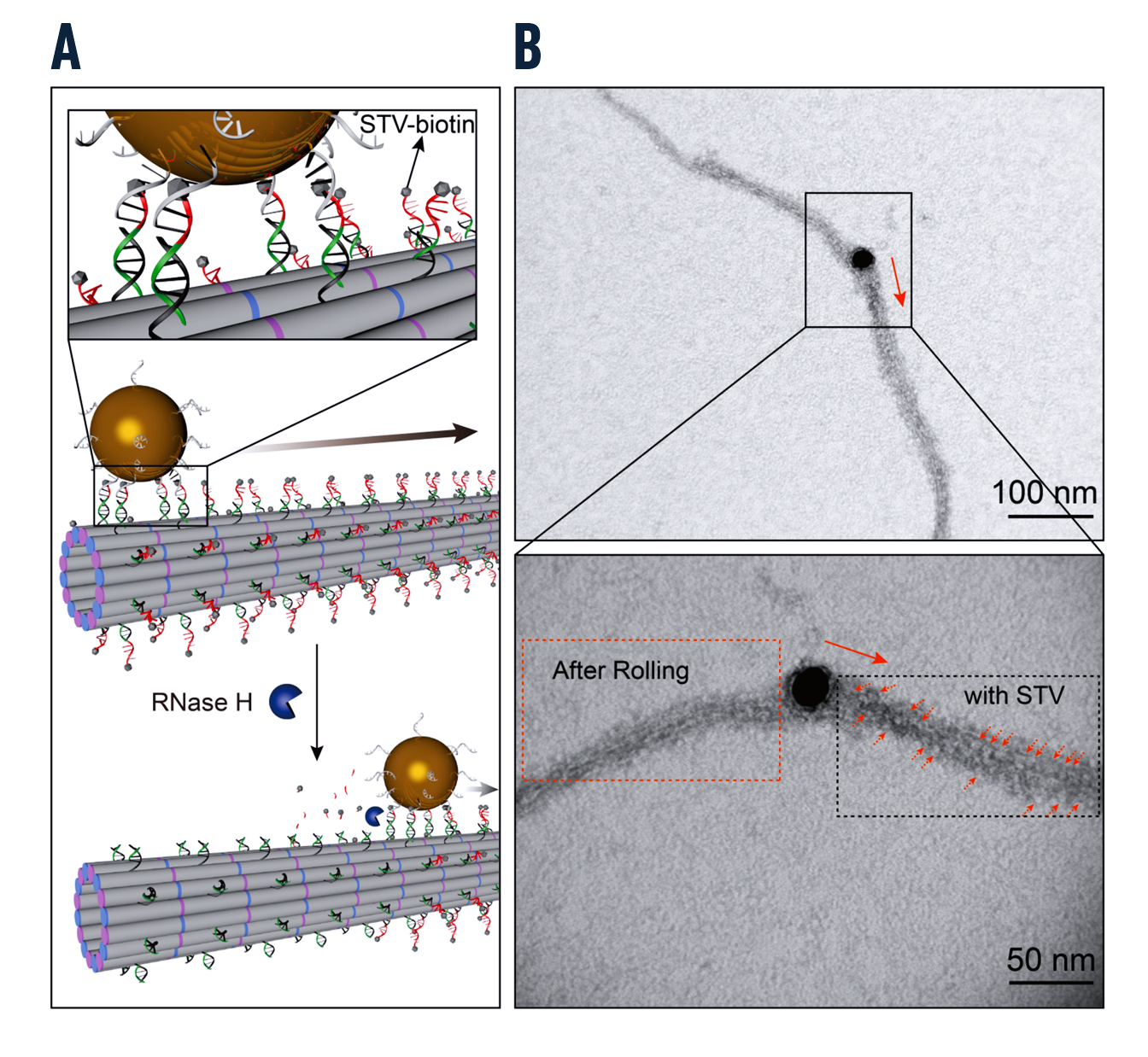
RNase H 通过 RNA 和 DNA 分子的杂交驱动 SUV 沿着 DNA 细丝滚动(图 5 和 6)。透射电子显微镜证实了 SUV 沿 DNA 细丝的结合和运输(视频 4)。
金纳米粒子提供了对生物货物以外运输机制的深入了解。结果表明,这些粒子也沿着由 RNase H 驱动的 DNA 细丝在液滴内移动(图 7)。
结论 | 技术与生物学交界处的合成细胞
这项研究强调了 DNA 纳米技术和微流体在复制生命系统和自下而上构建合成细胞方面的巨大潜力。然而,主要挑战仍然是在合成复制品中复制活细胞的一些多功能特征,例如细胞内运输、通讯和组织。
添加 ATP 后,含有分裂 ATP 适体的 DNA 瓦片的聚合为本文描述的合成模型提供了更高的生物学意义。此外,虽然比在活细胞中慢得多,但建议的wu机金纳米颗粒和脂质囊泡沿 DNA 细丝的运输激发了未来的研究。
“一项具有挑战性但有见地的实验将是在隔间内的单个货物水平上沿着基于 DNA 的细丝监测货物运输”,作者建议。他们强调说:“活细胞中微管上囊泡的运输速度仍然要快得多”。
微流体封装过程为模拟活细胞铺平了道路。在这项研究中,通过 picoinjection、融合或光触发释放笼状化合物,成功实现了在将 DNA 细丝封装成油包水液滴后分子的顺序添加。
“沿着这条路线,我们可能会在技术和生物学之间的界面设计合成细胞,用于生物医学、机器人药物输送、纳米机械、人工细胞信号传导和通信等领域,”作者总结道。
参考
- Zhan, P., Jahnke, K., Liu, N. et al. Functional DNA-based cytoletons for synthetic cells. Nat. Chem. (2022).
