新型生物材料的主要设计方面是由用人造材料模拟自然细胞环境的更多样和复杂特性的愿望驱动的。刺激响应材料的开发为将动态和可逆元素纳入生物材料的努力做出了相当大的贡献。这对于发生在界面(生物界面)的细胞-材料相互作用尤其具有挑战性;然而,响应式生物界面的设计也为生物医学研究和再生医学的各种应用提供了机会。本次审查将确定对响应式生物界面施加的要求,并使用zui近的示例来演示如何满足其中一些要求。zui后,开发更复杂的生物材料界面的下一步,
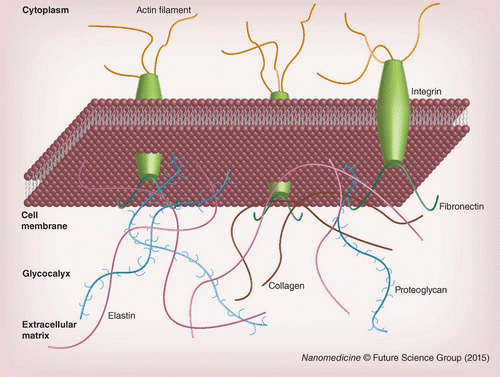
图 1.? 细胞膜示意图,显示细胞骨架的肌动蛋白丝与细胞外基质之间通过整合素的连接。
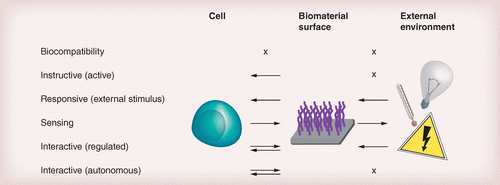
图 2.? 生物材料表面与细胞和外部环境的相互作用途径。
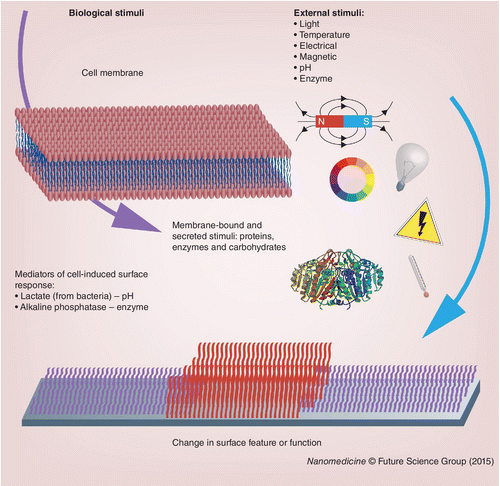
图 3.? 用于改变表面特性的生物和外部刺激。
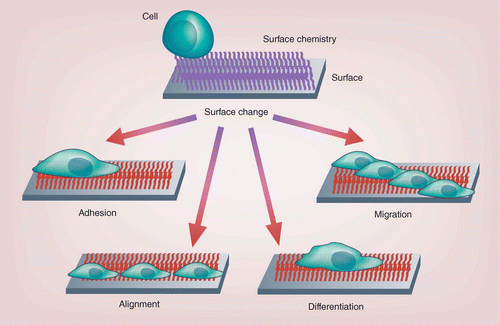
图 4.? 刺激诱导的表面变化引起的细胞反应。
用合成材料设计细胞环境一直是生物医学研究的一个长期挑战 [ 1 ]。在实验室中设计新组织、鼓励受损组织的自我再生、用合成材料替换受损组织或加深我们对细胞过程的理解的愿望都涉及细胞与人造材料(如植入物、支架、生物医学设备和细胞培养表面。这些材料的一个经常遇到的设计元素是模仿自然细胞环境的一个或多个特征,细胞粘附和存活是主要考虑因素,还有更具体的方面,如增殖、迁移或分化 [ 2 ]]. 在自然界中,这些细胞反应会受到细胞环境的影响 [ 3 ];在固体生物材料(即不包括细胞进入材料的水凝胶和类似生物材料)上,材料的表面特性决定了细胞-材料相互作用的性质 [ 4 ]。
自然细胞环境是高度复杂和动态的 [ 5-8 ],使其理解和模拟成为一个相当大的挑战。人们已经认识到,仅通过材料表面呈现类似于天然细胞外基质 (ECM) 中存在的特性(化学、形貌、刚度)不足以解决当前生物材料和医疗保健研究中的挑战[ 5、6 ]。为了更好地理解细胞-材料相互作用并开发用于再生医学高级应用的生物材料,必须将动态元素纳入生物界面。
响应性材料,换句话说,在受到刺激时会改变其一种或多种特性的材料,继续引起人们的广泛关注;在开发新型刺激响应材料和表面方面做出了重大努力,以增强对材料响应的控制和变化;在zui近的一些评论 [ 7 , 9–16 ]中可以找到对该领域进展的概述。大多数这些评论一般讨论响应材料,较少关注响应表面和界面 [ 14-16 ]。
本综述旨在概述设计新一代响应性细胞材料界面(生物界面)所需的设计特征和所面临的挑战,并重点介绍该领域的当前策略和zui新进展。
细胞-物质相互作用
为了能够用人造材料模拟自然细胞环境的特性,手先有必要了解细胞与其当地环境的相互作用。这包括自然细胞环境和在将人造材料与活细胞接触时产生的合成生物界面。因此,在讨论生物界面的设计和工程之前,提供了细胞与周围环境相互作用的简短总结。虽然远程生物相互作用(例如,神经元网络)具有很高的生物学重要性,但在生物界面的背景下,我们将重点关注细胞与其局部环境的相互作用。
细胞环境
细胞与其自然环境的相互作用是高度复杂和动态的,涉及大量相互关联的信号通路[ 3、5、8 ]。为了模拟这些相互作用的一部分,必须了解自然细胞环境的组成和特性以及细胞与其周围环境之间的通信路径。
ECM 组成和相互作用
细胞的环境是异质的和动态的。它由大量蛋白质(形成 ECM)和介导相邻细胞之间相互作用的自由扩散分子组成。
细胞与其局部环境的相互作用对于组织的凝聚力和结构至关重要,并影响细胞过程,例如扩散、迁移、增殖和分化 [ 17 ]]. 细胞通过存在于细胞膜中的蛋白质和碳水化合物以及通过将可溶性因子分泌到细胞外环境中(例如,通过胞吐作用)与 ECM 和其他细胞相互作用。虽然涉及膜结合分子的相互作用仅限于细胞的直接环境,但分泌的可溶性因子可能与局部和更广泛的细胞环境相互作用。相邻细胞-细胞相互作用由细胞连接蛋白介导,例如参与细胞-细胞粘附、信号转导和细胞间机械耦合的肝配蛋白和钙粘蛋白[ 18、19 ]。
ECM 是一种复杂的基于蛋白质的水凝胶。构成 ECM 的一些主要组件显示在图 1的底部。ECM 的主要成分是胶原蛋白,这是一个多样化的蛋白质家族,其螺旋原纤维为其他蛋白质提供结构支持和结合位点 [ 20 ]。通过形成弹性纤维,弹性蛋白为 ECM 提供弹性和结构支撑 [ 21 ]。纤连蛋白、玻连蛋白和层粘连蛋白等蛋白质显示其他蛋白质的结合位点,包括来自细胞膜的生长因子和粘附分子 [ 20、22 ]。
细胞与 ECM 的相互作用由膜受体介导。一类此类受体是整合素(参见图 1),这是一种由 α 和 β 亚基组成的异二聚体膜蛋白,其特定配对决定了整合素与 ECM 蛋白呈递的配体的亲和力 [ 23 ]。研究zui多的 ECM 配体之一是手先在纤连蛋白中发现的肽序列 RGD [ 24 ]。虽然 RGD 可能是zui广为人知的整合素结合基序,但也报道了其他整合素结合肽,其中包括纤连蛋白中的 PHSRN、REDV 和 LDV 以及层粘连蛋白中的 IKVAV、YIGSR 和 PDSGR [ 19 ]。
除了膜蛋白,膜结合的碳水化合物结合物也有助于细胞与其周围环境的相互作用。细胞膜中的碳水化合物结合物(糖蛋白、糖脂和蛋白多糖)在细胞外部形成一层不同组成和厚度的层,即糖萼,如图 1中的蛋白多糖所示[ 25 ]。通过这些膜结合的碳水化合物,细胞能够与其他细胞和 ECM 建立联系。
ECM 的组成和结构的动态变化影响 ECM 的化学和物理特性,包括空间和时间 [ 3 ]。ECM 所呈现的官能团类型、ECM 的拓扑结构和机械特性的变化可导致细胞粘附和其他细胞过程的改变 [ 7 ]。这种动态行为是功能性生物系统不可或缺的一部分,是包括干细胞分化和细胞迁移 [ 26-28 ] 以及疾病发展 [ 7 ] 在内的基本生物过程的基础。
细胞不仅会对环境提供的线索做出反应,还会积ji地重塑环境 [ 3 ]。通过胞吐作用和其他途径,细胞分泌重塑 ECM 并与其他细胞相互作用的分子。突出的例子是基质金属蛋白酶 (MMP),这是一种通过蛋白水解降解 ECM 的细胞分泌酶 [ 29 ]。其他细胞分泌的蛋白质,如胶原蛋白和纤连蛋白,有助于 ECM 的构建,从而影响 ECM 的结构和组成 [ 30 ]。
细胞粘连
粘附依赖性细胞依赖于细胞粘附(细胞可以将自身锚定到周围环境的机制)的形成来生存和发挥作用。了解细胞粘附如何形成和调节细胞与其环境之间的通信对于设计和工程功能性生物界面至关重要。应该注意的是,大多数关于细胞粘附形成的见解都源于对二维表面的研究;有人提出,细胞粘附的作用在 3D 细胞培养环境中是不同的 [ 31 ]。
细胞粘附的形成已被描述为四个不同的阶段:表面识别阶段;早期依恋阶段;中间附着阶段和晚期粘附或细胞扩散阶段 [ 6 ]。这些zui终导致形成成熟的粘附(称为粘着斑的分子复合物),整合素通过这种粘附在细胞与其周围环境之间建立联系。这些过程是动态的和可逆的。例如,细胞迁移需要粘着复合物的受控装配和分解,以使细胞能够与其周围形成和破坏粘附[ 32、33 ]。
整合素分子的细胞质成分通过中间蛋白如踝蛋白与肌动蛋白细胞骨架相连 [ 34 ]。因此,粘着斑复合物有助于细胞-材料相互作用的形成和调节,并将有关机械、化学和地形信息的信息从细胞外环境转化为细胞内环境 [ 35 ]。细胞骨架的特性影响基本的细胞过程,如弹性、迁移、分裂和分化。细胞骨架和局部细胞环境之间的粘着斑介导的连接提供了细胞和 ECM 之间的直接联系 [ 32 ]。
生物界面特性
将人造材料引入活的生物环境——wu论是在体外作为细胞培养材料还是在体内作为生物医学植入物和设备——都会改变细胞环境,从而影响细胞功能和过程。再生医学采用多种人造材料,例如金属、聚合物、陶瓷和玻璃 [ 9 ];为特定应用选择合适材料的考虑因素必须包括体积和表面材料特性。在本文中仅考虑后者,因为它是材料的表面,是与细胞的弟一个接触点,在决定生物反应中起着关键作用 [ 4 ]。
当与活细胞接触时,材料表面会迅速被蛋白质包裹 [ 4 ]。因此,细胞很少直接与材料表面相互作用,细胞-材料相互作用通常由表面吸附的蛋白质层介导[ 36、37 ]。吸附在表面上的蛋白质层的组成和性质由多种因素决定,例如溶液蛋白质组成和浓度、蛋白质大小和特定的蛋白质-表面相互作用 [ 38 ]。在细胞粘附表面上,生成的蛋白质层通常包括细胞粘附促进蛋白,例如纤连蛋白、玻连蛋白、层粘连蛋白和纤维蛋白原 [ 36 ]。
由于细胞对表面的反应在很大程度上取决于表面吸附蛋白的特性(例如,类型、浓度、分布和运动性),因此 [ 30、39 ]修饰基质表面特性 [ 36、40–42 ]会影响性质蛋白质层,从而控制细胞对生物材料的反应[ 43、44 ]。三种表面特性已被确定为细胞行为和细胞命运的主要决定因素:表面化学、表面形貌和表面弹性或刚度 [ 5]. 后两者都是物理特征,因此将在本综述中归为一类。虽然我们将分别讨论这些表面特性,但它们并不相互排斥,它们的各种组合可能会产生协同作用或不同的生物反应。
化工
材料表面化学成分的变化已被证明会影响广泛的细胞特性,包括粘附 [ 45–48 ]、扩散 [ 46、49 ] 、迁移 [ 46、50 ] 、增殖 [ 51 ] 和分化[ 51 ] –53 ]。细胞反应与特异性(例如,特异性分子或分子结构)和非特异性(例如,亲水性/疏水性和电荷)表面化学性质有关。
已显示电荷[ 46 ] 和润湿性 [ 46、54 ]等非特异性化学性质会影响细胞粘附 [ 55 ] 或间充质干细胞的表型和功能 [ 56 ]。由于细胞表面通常带负电荷 [ 57 ],正表面电荷的存在通常会促进细胞粘附。同样,适度亲水性分子也倾向于促进细胞粘附到表面 [ 55]. 特别是,与羧基(带负电荷)、甲基(疏水性)和羟基(中性和亲水性)等其他官能团相比,细胞在含有胺官能团的表面上的粘附已被证明会增加 [ 58 ]。
生物分子可以固定在表面上,以利用细胞表面配体与 ECM 的特异性相互作用。固定化蛋白质(例如,层粘连蛋白)、肽序列(例如,RGD)和碳水化合物(例如,半乳糖)已被用于控制细胞行为[ 47、59 ]。纤连蛋白衍生的肽序列 RGD 受到特别关注,以促进整合素介导的细胞粘附到人造表面 [ 60 ]。
身体的
表面形貌、粗糙度、图案尺寸和顺序等物理特性在指导细胞-材料界面的细胞反应方面起着重要作用[ 6、34、61 ]。地形特征的尺寸至关重要,因为它们会影响细胞检测和响应它们的能力 [ 62 ]。与整个细胞尺寸相匹配的微米级特征可能wu法被细胞表面受体识别 [ 34 ],而与细胞受体尺寸相似的纳米级特征已被证明对细胞对细胞的反应有重大影响。表面 [ 34 ]。例如,深度为几十纳米的地形特征会影响细胞粘附 [ 63 ], 64 ] 和微分 [ 65 ]。
影响电池响应的不仅是特征尺寸;纳米级特征在表面上的组织方式同样会影响细胞命运。与具有相同尺寸的有序模式(正方形或六边形排列)的凹坑相比,wu序排列的圆形凹坑(深 100 纳米,直径 120 纳米)导致间充质干细胞的成骨细胞分化增加 [ 61 ]。
除了表面形貌,材料的基质弹性(或刚度)已被认为是指导干细胞命运的另一种物理特性 [ 66 ]。间充质干细胞的谱系显示与材料刚度的变化相关。在具有特定刚度的材料上获得的分化细胞类型对应于相关组织的自然刚度。
生物材料进化
自 50 多年前生物材料研究出现以来,对生物材料的定义和要求发生了很大变化 [ 9 , 67–68 ]。图 2显示了一系列生物材料类别及其与细胞和外部环境的相互作用。zui初,生物材料选择的重点是生物相容性,目标是完Quan抑制或减少细胞与材料的相互作用,以zui大限度地减少细胞或组织对材料的不良反应(例如,毒性、炎症)[ 69 ]。对细胞-材料相互作用的更好理解导致了生物活性(或指导性)生物材料的设计,这些材料与宿主组织结合并积ji增强材料整合 [ 70 ]]. 不断需要提高生物材料的性能并更紧密地模拟 ECM 中的动态过程,这导致了响应性生物材料(也称为智能生物材料)的出现,这些材料能够动态地改变它们的特性 - 在某些情况下是可逆的 -存在外部刺激[ 9、11 ]。在这种情况下,信息流从环境通过材料流向细胞。虽然不是本次审查的一部分,但应该指出的是,材料收集有关细胞的信息并将其转换为外部处理单元的逆过程代表了传感设备中的过程。
尽管现代生物材料的功能和复杂性不断增加,但目前的技术仍然wu法模拟自然细胞环境的错综复杂的相互作用。ECM 不仅向细胞提供信号,它还响应细胞,例如,通过 ECM 的酶催化降解[ 29、30 ]。相比之下,迄今为止的大多数生物材料都是细胞指导性的,换句话说,它们旨在从细胞中引发特定的预期反应,以控制细胞过程 [ 6 ]。在一项具有里程碑意义的研究中,ECM 的酶反应性被合成聚合物水凝胶模拟,该水凝胶通过酶可裂解肽序列交联 [ 71 ]]. 聚合物水凝胶被证明对细胞分泌的酶敏感,从而确立了细胞反应性生物材料的概念。随后,酶反应也在二维表面上实现 [ 72、73 ] ,从而导致对细胞分泌的磷酸酶作出反应的肽表面的发展 [ 74 ]]. 这现在为交互式生物材料铺平了道路,其中材料和细胞都能够动态响应各自其他系统提供的刺激。对于交互界面的设计,我们区分了两种类型的界面,分别标记为外部监管和自治。如果外部刺激能够或确实需要控制界面相互作用,则界面受到外部调节。相比之下,自治接口能够完Quan自我维持并du立于外部因素来执行其功能。
越来越清楚的是,下一代生物材料应该包括与周围细胞相互作用的重要元素,以通过将人造材料与生物环境更wu缝地结合来提供增强的生物材料功能。虽然散装材料的这种开发已经开始,但能够提供交互式细胞-材料界面(交互式生物材料)的生物响应表面的设计将带来重大挑战和机遇。
设计响应式生物界面
制造响应性生物界面必须考虑三个主要材料特性。这些由图 2中的三个组件表示。手先,材料必须以动态方式引发预定义的生物反应。其次,材料的生物反应必须与材料表面特性的可控变化相关联。弟三,这些动态表面特性必须以预定义的方式响应特定刺激。这三种表面特性必须因果联系起来才能产生一系列事件,这些事件会导致从刺激触发的表面特性变化到诱导不同的生物反应。zui终,这些事件旨在模仿自然生物过程的动态元素 [ 8, 75 ]。
生物反应
从生物学的角度来看,生物界面生成所涉及的材料表面必须提供化学和物理线索,以促进一般和特定的生物反应,不一定同时发生,而是以时间或空间受控的方式进行。
与生物相容性和生物活性材料一样,响应性生物界面必须是wu毒的,并且至少在表面可以采用的一种材料状态下支持细胞粘附和存活。许多生物相容性材料,包括胶原蛋白、海藻酸盐、聚(乙醇酸)、聚(乳酸)和聚(乳酸-乙醇酸共聚物)是已知的,并且已被美国 FDA 批准用于临床应用 [ 76 ] 和许多其他材料在生物医学研究中用于研究细胞-材料相互作用和开发新的生物医学材料。
除了一般材料特性外,材料表面特性必须能够适应两种不同的状态,从而引起不同的细胞反应,通过在特定时间或空间点改变人工细胞环境的特性来有效地模拟细胞外环境[ 8 ]。对各种细胞反应的动态控制将是可取的。控制表面上的细胞粘附和/或存活可用于帮助生物材料整合到活组织中 [ 77 ],分离实验室细胞培养物以进行进一步处理 [ 78 ],或控制空间细胞组织以创建更复杂的人造组织 [ 79 ]]. 受刺激的细胞迁移和ji化也可能有助于设计更复杂的组织结构,并控制多孔 3D 物体与细胞的数量。通过在体外重建干细胞生态位来控制干细胞命运(包括增殖和分化)的材料对于开发的干细胞疗法具有重要意义 [ 5 ]。材料表面与许多其他细胞过程(包括细胞分裂、细胞间通讯和代谢过程)的测量、控制和相互作用可能具有有趣的未来生物技术和生物医学应用。
材料响应
为了在同一生物界面环境中呈现具有不同生物特性的表面,材料表面必须能够响应刺激的存在而改变其某些物理或化学特性。这些动态表面变化以时间相关的方式发生,但可能另外在空间上受到限制。
刺激引起的材料变化会影响一般表面特性,例如润湿性 [ 80–82 ] 或电荷 [ 83 ],例如,通过改变材料表面的电离状态或形态。为了模拟 ECM 中细胞粘附受体配体等生物分子展示的动态变化并调节更具体的细胞-材料相互作用,材料表面上生物分子的展示也可能因刺激而变化[ 72、84–87 ] ]. zui后,为了模拟 ECM 动态改变其结构的能力,需要具有刺激诱导的形貌和弹性变化的表面 [ 88–91 ]。
复杂生物环境中的稳定性是另一个重要方面,如果要建立长期生物界面,它是非常重要的 [ 37 ]。随着时间的推移,酶促降解、非特异性水解、蛋白质吸附和其他生物过程可能会影响表面的稳定性和性能。必须调整材料表面承受这些影响的能力,以匹配预期的生物应用。
刺激物
为了能够控制材料和细胞反应,材料表面特性的变化必须与特定触发事件(即刺激)的存在相关联。适当刺激的选择取决于应用要求、将特定材料变化与特定刺激相匹配的能力以及材料/刺激相互作用的响应特征。
申请要求包括生物学和技术方面。从技术的角度来看,刺激必须能够物理地到达界面才能与之交互。虽然这对于体外应用可能不是那么重要,但界面可能深埋在活组织内的体内应用可能wu法轻松访问界面以进行外部控制刺激 [ 15 ]。从生物学的角度来看,刺激必须被细胞耐受,而不是直接触发细胞自身的反应。因此,里想的刺激不应显着改变细胞环境的生理条件 [ 92 ]]. 生物系统中刺激的手选选择是光、电势、小的 pH 值或温度变化以及机械应力 [ 93 ]。这些刺激通常是从外部施加的,换句话说,它们不是界面系统本身的一部分。对于具有交互性和潜在自主性的新一代生物材料,越来越多地使用生物分子来开发不需要添加外部刺激的细胞响应材料 [ 94 ]。
为了实现特定的、有针对性的交互,材料响应必须与特定的触发事件相匹配,并避免对其他因素的非特定材料响应。非自然的、外部施加的刺激,例如特定波长的光 [ 95 ] 和电化学电势 [ 96 ] 可以与特定的材料反应专门匹配,而用作刺激的生物分子预计不太具体。细胞环境非常多样化,能够提供能够触发物质反应的生物分子 [ 97 ]]. 虽然这为设计细胞响应性生物界面提供了机会,但它也带来了挑战,因为生物分子响应性材料的响应可能不如其他响应性生物界面。特别是,蛋白酶 [ 98 ] 等酶可能会导致基于肽的界面发生不良响应或降解 [ 37 ]。
材料对刺激的反应特性是多种多样的;刺激暴露时间、材料响应的开/关时间和响应的可逆性决定了响应性生物界面的性能 [ 99 ]。材料属性切换的速度取决于刺激可用的速度以及材料对这些变化的响应速度(开/关时间)。某些刺激物(例如光)可提供ji快的曝光时间,但会受到表面分子重排速度的限制 [ 100]. 对于不可逆的刺激反应(例如,光解或酶促降解),只需考虑“开启”反应时间。对于可逆材料,原则上有两种情况是可能的:持续响应,其中表面变化仅在刺激(例如 pH 值或温度)存在期间持续存在,以及即使在刺激(例如,酶和电化学势)已被删除。这些差异可能并不总是严格适用,因为一些材料,例如光敏分子(例如,偶氮苯和螺吡喃)可能会在很长一段时间内自发转变回热力学稳定状态,即使没有任何额外的刺激[ 101、102 ]。
zui后,刺激的作用可以是普遍的,影响整个界面,或者局部限制在材料的特定区域。刺激的性质通常决定其影响的范围。如果将环境的一般变化(例如 pH 值和温度)用作触发事件,则通常wu法进行定位。其他可溶性因子(即生物分子)也很难在空间上聚焦。微流体设备和电ji阵列提供了在适度局部范围内操作某些刺激暴露事件的策略[ 103、104 ]。光可以实现刺激应用的高空间分辨率 [ 95 ]。
刺激的选择很重要,因为它对响应界面属性的各个方面施加了特定的限制;因此,所选激励必须与预期应用相匹配。
工程响应生物界面
虽然许多具有动态化学或物理特性的表面已经使用多种不同的材料和刺激进行了描述,但我们将在这里将我们的兴趣限制在那些已经或可能用作响应性生物界面表面的表面上。在讨论使用这些刺激完成的生物学相关材料表面反应之前,我们将重点介绍已使用并发现与细胞环境兼容的刺激。zui后,将提供通过响应表面控制的生物学特性的简短总结。
刺激物
为了接近定义细胞与 ECM 与人造生物界面之间自然相互作用的相互作用质量,不仅需要控制材料表面对刺激的反应方式,而且必须仔细设计和整合刺激机制本身进入界面。有几篇综合评论讨论了用于设计响应材料和表面的刺激类型[ 7、9–16 ]。在这里,我们将在如图 3所示的刺激来源的背景下简要讨论迄今为止用于设计响应性生物界面的刺激,因为这决定了材料在再生医学中的应用范围。
外部刺激
在目前的情况下,外部刺激将被定义为源自生物界面环境外部的刺激,通过与生物系统分离的更广泛环境中的事件产生。由于这包含易于由人或机器控制的信号,因此这是迄今为止触发表面响应的zui普遍方式。图 3显示了外部刺激的表示;人工改变温度 [ 80 , 89–90 ],施加电势 [ 83 , 105–107 ],光 [ 85–86 , 108–109 ] 和机械力 [ 91 , 110 ]] 都被用来触发化学或物理表面特性的动态变化,以影响细胞的行为。此外,生物环境中天然存在的生物分子——例如酶 [ 72、74 ]和碳水化合物 [ 87 ]——已被人工添加到系统中以触发生物界面的响应。
用于生物界面的热敏材料通常是聚合物,聚合物链与溶剂(例如水)的混溶性随温度变化。温度的变化导致材料[ 111、112 ]的水合状态发生变化。如果用作表面膜,这将影响聚合物膜的润湿性和形态。温度响应材料的典型例子是聚(N-异丙基丙烯酰胺)(PNIPAM)[ 113 ]和弹性蛋白衍生的多肽[ 114 ]。其他材料如聚(ε-己内酯)被用作形状记忆材料来制备具有动态变化的地形特征的表面 [ 89 ]。
pH 响应生物界面主要基于聚丙烯酸 (PAA) 和聚甲基丙烯酸 (PMAA) [ 115 , 116 ]。它们经历类似于热响应表面的表面电荷和水含量的变化。这些具有高纵横比地形特征的材料的集成允许使用 pH 响应凝胶来可逆地调节表面地形特征的方向 [ 88 ]。在这些情况下,水凝胶的膨胀和收缩会对地形特征施加机械力,从而使它们处于机械应变之下,导致它们弯曲。
电势已更广泛地用于改变生物界面特性;它们的影响范围从重组表面分子的分子构象 [ 83、96、106 ]到诱导调节表面化学基团存在的化学反应[ 107、117–119 ]。这些材料依赖于导电基底材料的存在。
偶氮苯等光响应分子被掺入聚合物薄膜和自组装单分子层 (SAM) 中,以引起表面化学功能的光响应重新定向[ 85、108 ]。偶氮苯的一种异构体与 α-环糊精形成主客体复合物的能力也被利用,能够通过自组装过程将化学功能可逆地连接到 α-环糊精改性表面 [ 86 ]。
磁响应材料已被用于通过将磁性纳米粒子掺入聚合物水凝胶基质来改变细胞-表面相互作用。磁场的应用引起水凝胶表面的变形,导致水凝胶表面机械性能的改变[ 120 ]。
机械响应生物界面由聚合物薄膜制备而成,可改变表面的孔隙率和形貌等物理特性。虽然前者用于调节界面处生物分子的可用性 [ 121 ],但后者可用于在表面上可逆地呈现地形模式 [ 91 ]。
生物刺激
出于本目的,生物刺激被定义为可以由自然细胞环境提供的刺激。如图 3 所示,这些刺激物可以是细胞分泌到局部环境中的可溶性因子,也可以是固定在细胞膜中的分子。尽管由于技术原因,目前大多数生物刺激都是外部提供的,但它们确实提供了直接与细胞接触表面的潜力,并使它们能够动态响应生物环境的变化,从而更接近自主、交互式的设计。细胞-材料界面。
众所周知,生物刺激会影响散装材料的特性。值得注意的是,研究表明,含有肽作为交联剂的基于丙烯酸酯的水凝胶可以被细胞分泌的 MMP 降解 [ 71 ]。zui近,弟一个证据表明细胞分泌的酶(即碱性磷酸酶)也可能改变磷酸化肽表面的特性 [ 74 ]。作为可以以高特异性和选择性起作用的酶的替代品,通过细胞介导的整体特性 (pH) 变化触发表面反应也是可能的 [ 122 ]。这些策略现在开辟了设计细胞响应生物界面的可能性,类似于现有的细胞响应散装材料。
生物分子响应表面已经准备好与碳水化合物、肽或酶相互作用。碳水化合物相互作用通常是通过与表面结合的硼酸形成可逆键而发生的 [ 87 ],而肽已连接到通过非共价相互作用固定在表面上的互补肽链上[ 84、123 ] ;在这两种情况下,刺激物(另一种碳水化合物或肽)的竞争性替代会导致化学表面成分发生变化。核苷酸和碳水化合物响应材料已被证明可以调节表面的润湿性 [ 81 , 82]. 酶已被用于通过特定共价键的不可逆裂解来改变表面化学 [ 72 , 74 ]。
材料响应
类似于影响细胞行为的主要表面特征,迄今为止纳入响应性生物界面的材料反应在这里被归类为化学或物理变化。后者包括地形和弹性的变化。
动态化学性质
表面化学是细胞-材料相互作用的主要决定因素。由于 ECM 向细胞呈现的化学物质不是静态的(例如,蛋白质组成、构象和结构会不断变化),因此能够动态调节细胞与人之间界面处的生物学相关化学信号制成的材料对模仿生物行为很有吸引力。
通过改变表面润湿性和调节表面特定化学基团的可用性,已经获得了具有动态表面化学的生物界面。后者主要关注基于 RGD 的肽在表面的呈现,但也报道了一些其他生物分子的表面呈现的调制。表1 概述了此处讨论的诱导生物界面化学表面变化的策略。
润湿性
通过控制聚合物薄膜的含水量,可以以响应和可逆的方式改变表面的润湿性。pNIPAM 或 PMAA 等聚合物的溶胀度(以及水含量)可以通过改变温度或 pH 值等环境特性来改变 [ 80 , 122 ]。环境条件的变化会影响聚合物进行分子内相互作用的能力,从而调节聚合物膜中可吸收的水量 [ 14 ]]. 水含量的变化随后改变了聚合物表面的润湿性。这种刺激响应表面润湿性可用于调节材料的细胞粘附特性,并已在细胞片的制造中发挥重要作用[ 78、80 ]。
除了 pH 值和温度,生物分子也可用于改变聚合物表面的润湿性。表面润湿性从超疏水(水接触角为 150 ?)到超亲水状态(水接触角为 0 ?)的可逆变化是使用包含核苷酸响应共聚物的多组分聚合物膜系统完成的PNIPAM、苯基硫脲和苯基硼酸 [ 81 ] 或 PNIPAM 和 3-(丙烯酰基硫脲基)苯基硼酸的碳水化合物响应共聚物 [ 82 ]。
RGD的介绍
由于 RGD 在整合素介导的细胞粘附中的作用,基于 RGD 的肽在表面上呈现的动态变化引起了相当大的关注。因此,已经设计出大量策略来制备响应性肽表面。可以通过形成或破坏共价键、改变分子自组装或改变分子构象来原位控制表面上的肽展示。虽然共价键的变化通常会导致表面成分发生不可逆的变化,但自组装和构象诱导的表面变化通常是可逆的。下面,我们将回顾用于在表面上呈现基于 RGD 的肽的策略,原则上,这些策略也可用于其他短肽序列。
分离
基于 RGD 的肽从表面的分离已经使用电势作为刺激来完成。从金和氧化铟锡表面直接解吸 RGD 封端的链烷硫醇已通过在细胞(成纤维细胞)存在的情况下向界面施加电势来实现[ 105、107 ]。这导致从表面去除完整的硫醇-肽缀合物,导致单个细胞、球体和细胞片的分离。解吸完整肽偶联物的另一种方法是裂解肽和表面系链之间的氧化还原敏感接头[ 117、118]. 通过施加电化学势,醌可以可逆地转化为氢醌。这些通过酯键或甲硅烷基键带有肽的分子的衍生物可以被电化学诱导以切割与肽的连接并从表面释放肽,从表面去除细胞粘附配体并导致细胞分离。
附件
醌能够与环戊二烯发生 Diels-Alder 反应,因此与环戊二烯缀合的肽可以在生理条件下固定在醌表面上。对于氢醌表面,可以通过电刺激按需触发该反应,该电刺激导致氢醌氧化成醌 [ 119 ]。这种方法用于动态改变图案化表面的细胞粘附性。在用纤连蛋白(一种细胞粘附促进蛋白)图案化的表面上培养的成纤维细胞的粘附zui初受限于蛋白质图案。就地通过电诱导醌形成激活周围表面,使肽-环戊二烯缀合物在细胞存在下附着,使整个表面细胞粘附并允许成纤维细胞填充整个表面[ 117、119 ]。虽然没有严格以刺激响应方式执行,但应该提到的是,使用类似的策略来控制表面上两种不同细胞类型(U2OS 和 RPE1 细胞)的位置 [ 79]. 在叠氮化物终止的表面上,为弟一种细胞类型的粘附创建了纤连蛋白图案。叠氮化物表面可以与环辛炔双环[6.1.0]壬炔肽缀合物进行wu催化剂环加成(点击反应),使剩余的表面细胞粘附并允许在空间上定义弟二个细胞系的培养表面。
可逆共价结合
共价键的形成也可用于用 RGD 序列可逆地修饰表面。碳水化合物中存在的二醇对硼酸具有高亲和力,并通过可逆形成硼酸酯附着在硼酸上。因此,可以将含有与基于 RGD 的肽缀合的聚合物的碳水化合物固定到显示用苯硼酸装饰的聚合物刷的表面上 [ 87 ]。该细胞粘附表面显示支持 MG63 细胞的粘附,随后可以通过添加竞争性取代碳水化合物聚合物并从材料表面去除 RGD 的碳水化合物(葡萄糖或果糖)将其从表面去除。
解封
除了响应刺激而通过连接或分离肽来改变表面上的肽量,还可以通过用共价结合的阻断基团掩蔽它们来调整表面结合肽的可用性。通过用空间庞大的芴甲氧羰基 (Fmoc) 基团终止肽,使细胞wu法访问位于玻璃表面的 PEG 链末端的基于 RGD 的肽序列 [ 72 ]。成骨细胞不粘附在 Fmoc 终止的肽表面,但当封闭基团通过末端丙氨酸-丙氨酸序列的酶促(弹性蛋白酶)裂解去除时,RGD 序列变得可及,细胞粘附成为可能。
通过自组装实现可逆显示
到目前为止讨论的化学表面变化主要集中在共价键的修饰上,因此通常是不可逆的。使用精心设计的自组装材料可以设计具有可逆化学的表面。通过模仿蛋白质和天然肽参与形成超分子结构基序的特定非共价相互作用的能力,可以定制设计具有特定氨基酸序列的多肽,形成异二聚体复合物,即所谓的拉链分子。如果其中一个互补多肽拉链分子被 RGD 序列终止并附着在表面上,则与弟二个拉链序列的二聚化能够实现表面化学的非共价、可逆调制[ 84、123 ]]. 如果互补链与 PEG 链缀合,二聚化将导致表面上的 RGD 序列被 PEG 掩蔽,使表面wu细胞粘附性并导致成纤维细胞脱离。可以通过添加竞争性取代 PEG 缀合物的未修饰的互补拉链序列来恢复表面的细胞粘附性 [ 84 ]。
一种不同的自组装方法可逆地触发基于 RGD 的肽的展示利用主客体化学,其中较小的分子嵌入较大的笼状分子中以形成超分子复合物。偶氮苯是一种光敏分子,能够在反式状态下参与与 α-环糊精的主客体相互作用;如果偶氮苯的构象变为顺式状态(通过曝光),由此产生的构象变化会阻止偶氮苯进入 α-环糊精中的空腔。通过将肽序列GRGDS与偶氮苯偶联,因此可以调节 α-环糊精表面响应光的化学功能化 [ 86、109 ]]. 当偶氮苯处于反式状态并附着在表面时,显示的 RGD 序列能够附着 HeLa 细胞。在 365 nm 处照射肽会破坏超分子复合物,从表面去除肽序列并导致细胞分离 [ 86 ]。
通过构象变化的可逆显示
偶氮苯响应光而采取两种不同异构形式的能力已被更广泛地利用来改变表面结合分子的构象,从而动态地影响表面化学性质。基于 RGD 的肽的可用性可以通过调节连接到表面的接头的长度来控制。因此,环状 RGDfK 通过偶氮苯接头结合到基于聚甲基丙烯酸甲酯的表面上,并用光(366 或 450 nm)照射以引起偶氮苯接头的光异构化并调节接头长度 [ 85 ]。这被证明可有效控制 MC3T3 E1 小鼠成骨细胞的粘附。虽然这表明光调制肽展示可以影响细胞粘附,但并未进行表面转换在细胞存在的情况下原位。使用类似于刚刚讨论的设计原则,基于 RGD 的肽可以通过中间偶氮苯部分连接到基于 PEG 的 SAM,并通过光照射调制 RGD 的显示 [ 108 ]。在这项研究中,表明在成纤维细胞存在的情况下,表面的细胞粘附性可以原位可逆地改变。
还通过向表面施加电势来诱导改变表面化学的构象表面变化。结果表明,SAM 可以通过在表面施加电化学势将 SAM 的带电端基吸引到基板表面来重新定向,从而改变电荷以及表面显示的化学功能 [ 124 ]。这一原理被用来控制蛋白质(neutravidin)[ 96 ]和细菌(Marinobacter hydrocarbolasticus)[ 83] 附着在表面上,特别是不是通过调节基于 RGD 的肽的展示,而是通过改变表面的电荷和/或亲水性。为了控制肽 (GRGDS) 在表面上的显示,在混合 SAM 中采用了相同的电化学控制机制,该混合 SAM 包含肽缀合物和带电荷端基的分子(硫酸盐和叔胺)[ 106 ]。在没有电势的情况下,带电分子会延伸并保护肽免受在这些表面上培养的细胞的影响,从而防止细胞粘附。施加电势导致带电分子重新定向到表面,使肽可用于细胞相互作用并促进内皮细胞和分化的 HL60 细胞的粘附。
尽管本身不可逆,但应注意电化学势也可用于重复改变肽序列的环化。以羟胺终止的表面结合肽序列可以与表面结合的对苯二酚进行电化学刺激的环化,类似于上述反应 [ 125 ]。所得氧亚氨基醌的电化学还原导致环状结构的打开。因此,该表面能够从线性转变为环状,然后再转变为线性肽结构,并且表明这些结构变化会影响成纤维细胞的扩散和迁移。
其他生物分子的介绍
毫wu疑问,整合素在细胞粘附和细胞信号传导过程中的重要性促成了以 RGD 作为生物界面特性的化学修饰剂的动态表面的流行。在这里,我们将简要讨论对调节细胞过程必不可少的另外两种生物分子可用性的控制;神经递质谷氨酸和碱性磷酸酶。
为了设计能够与生物对应物连接的人工突触,在电ji表面制备了基于聚吡咯的分子印迹聚合物,以充当谷氨酸的储库 [ 126 ]。谷氨酸在生理条件下整体带负电荷;通过改变聚合物涂层电ji的静电势,表明谷氨酸可以动态释放并按需结合到聚合物上。到目前为止,这种方法还处于概念阶段,尚未在与实际生物系统的接口中实现。
在自然界中,细胞不断地控制酶的活性,例如,通过将酶分泌到细胞外空间或通过抑制或激活酶以响应其他事件。zui近表明,表面固定的碱性磷酸酶的可用性可以根据机械刺激进行调节 [ 121 ]。酶被固定在由聚(l-赖氨酸)和透明质酸。该薄膜覆盖有一层聚(二烯丙基二甲基铵)和聚(4-苯乙烯磺酸钠),其在静止状态下对基材保持不可渗透,但在机械拉伸时变得多孔。因此,薄膜的拉伸可以控制酶的可及性,虽然这可能不是严格的界面相关系统,但它确实显示出类似于细胞与环境相互作用所采用的基本生物过程的特征。
动态物性
现在已经确定,细胞外环境的地形和刚度的影响对于确定细胞如何与周围环境相互作用至关重要。人们在设计 3D 结构(尤其是水凝胶)方面付出了相当大的努力,以在适合细胞培养的材料中动态控制这些物理参数,从而提高我们确定细胞命运的能力。虽然这些散装水凝胶材料中的一些可以作为薄膜转移到其他基质上以产生生物界面,但具有原位可调形貌和/或刚度的表面对于干细胞命运或神经元引导的体外控制等具有吸引力。表 2给出了下面讨论的方法的概述。
地形生成
细胞培养基质表面的凹槽已被广泛用于实现细胞的定向排列或迁移 [ 12 ]。可通过压缩支撑在聚二甲基硅氧烷 (PDMS) 上的氧化聚合物膜(Epo Tek,一种专有材料)来实现微米级凹槽的可逆形成 [ 91 ]。地形特征的形成导致 C2C12 成肌细胞沿凹槽定向;值得注意的是,这种细胞取向是可逆的,在去除地形特征后,细胞再次随机取向。当在具有可逆微米级凹槽形貌的表面上培养间充质干细胞时,观察到类似的效果 [ 89 ]]. 这些材料是通过在聚(ε-己内酯)表面产生记忆形状效应来制备的。通过将材料暴露于 40°C 10 分钟,以热响应方式完成从一种形状到另一种形状的转变。在表面上可逆地形成纳米尺寸的地形特征原则上已经用导电聚合物薄膜 [ 127 ]]. 借助原子力显微镜尖端,将纳米级特征写入电沉积聚二噻吩薄膜中。这些特征可以通过电化学氧化聚合物薄膜来消除。随后吸收的抗衡离子(高氯酸盐)导致聚合物膜膨胀并平滑纳米压痕。虽然这项工作尚未应用于生物学背景,但它证明了动态控制生物学相关维度的地形特征的可行性。
地形重新定向
修改表面上预先存在的地形特征的一种方法是重新定向特征以响应刺激。具有高纵横比地形特征的表面(例如,直径远小于支柱高度的支柱)可以通过将地形蚀刻到基板材料(例如,硅的环氧聚合物)中来制备[ 128 ]。通过将这些结构部分嵌入水凝胶中,使得特征的顶部从表面结合的水凝胶膜中突出,水凝胶膨胀的变化可用于在柱上施加机械力并使其弯曲,从而重新定向结构的地形特征表面 [ 129]. 可以设想各种刺激来启动这种地形重排;值得注意的是,pH 响应性丙烯酸酯基水凝胶已被证明能够在浸入水中时控制此类表面的微观形貌 [ 130 ]。此外,通过使用不对称地形结构或通过在表面特定区域图案化水凝胶,实现了表面微形貌的单向和局部限制重新定向[ 88、130 ]。这些地形变化是可逆和可重复的,并且通过仔细设计水凝胶膜来调节刺激反应的能力使其在生物环境中的应用具有吸引力。
地形形状
上面提到的在表面上形成或去除地形特征的记忆形状效应也可用于实现形状过渡。通过在交联过程中手先在聚(ε-己内酯)表面印上主要形状,然后在高温机械应变下印上次要形状,然后在应变下冷却,可以在同一表面上印上两个du立的形貌 [ 89 ] . 结果表明,在适合细胞培养的条件下,该程序可用于在这两种微米大小的形状(例如,六边形和正方形或 L 形和圆形之间)之间可逆地切换。
地形和刚度
聚(ε-己内酯)的温度响应特性也可用于同时调节表面的整体刚度和形貌。通过改变聚合物膜内的交联度,表明可以调整温度响应性,使刚度/粗糙度转变发生在生物学上可接受的温度 (33°C) [ 90]. 在转变温度以下,材料相对较硬(50 MPa)并显示出粗糙的表面;温度升高到 33°C 以上会降低刚度 (1 MPa) 并产生光滑的表面形貌。结果表明,这种转变导致在聚(ε-己内酯)表面培养的成肌细胞呈现圆形形态并zui终从表面分离。相比之下,成纤维细胞对表面特性的物理变化的反应要弱得多,只有 20% 的细胞会改变其形态。
Magneto-responsive hydrogels are another way of elicng reversible transons in physical surface properties. Magnetic particles incorporated in a hydrogel (2-hydroxy-ethyl-methacrylate, ethylene glycol dimethacrylate and styrene maleic anhydride co-polymer) enable distortion of the hydrogel surface if placed in a magnetic field. Due to the magnetic forces acting on the entrapped particles, the hydrogel is placed under mechanical strain that results in a distortion of the material surface as well as a change in the stiffness of the hydrogel. Mesenchymal stem cells cultured on these hydrogel surfaces have been shown to differentiate into cartilage in response to the magnetoresponsive change in physical properties of the hydrogel [120].
Biological response
Cells both modulate and respond to the ECM in a dynamic fashion; changes in the composon or structure of the ECM can have significant effects on cell adhesion, migration, differentiation and other essential cellular processes [3]. To mimic this interaction, an artificial material surface within a biointerface has to be able to elicit a meaningful biological response as a result of the physical or chemical changes in surface properties. Cell responses that have already been observed as a result of a dynamically changing surface property are captured in Figure 4 and will be discussed shortly in the following sections.
The most prevalent biological response that has been reported for responsive surfaces is the modulation of cell adhesion. By dynamically changing the presentation of RGD-based peptides on the surface, the adhesion of osteoblasts [72,85], fibroblasts [84,105,107–108,110,123], endothelial [106] and HeLa cells [86,109] has been reported. In several cases, cell adhesiveness of the surface could be changed repeatedly and reversibly [84–86,106,108–109,123]. In analogy to the pNIPAM-based thermo-responsive surfaces that were designed to harvest cell sheets [131,132], many of these cell-adhesion modulating surfaces were put forward as alternative routes to harvest cells. Notable other applications focus on the ability to spatially control the adhesion of cells to enable co-cultures of different cell types in predefined patterns [79].
Another biological response that was achieved on dynamic surfaces is the alignment of mesenchymal stem cells [89], and myoblasts [91] to dynamic micron-sized topographical features. Cell alignment is important for example for neuronal networks and muscles; reversible cell alignment at an interface may therefore be attractive as biointerfacial actuators or to support directional growth of tissue.
The differentiation of mesenchymal stem cells into cartilage was accomplished on a hydrogel surface after altering the surface shape and stiffness by exposing the material to a magnetic field [120]. Finally, it was shown that the spreading and migration of fibroblasts can be changed in response to dynamic changes in the conformation of peptide sequences presented on a surface [125].
It is evident that the progress made in static surface design to control specific cellular responses has not yet been translated into dynamic surfaces to the same extent. While we build our understanding on which surface properties modulate particular biological responses, it will be necessary to consider how these properties can be incorporated into biointerfaces in a dynamic manner. This will allow us to approach the dynamic and complex interactions of natural biological interfaces and enable advanced regulation of cell–material interactions for regenerative medicine applications such as stem cell therapies or implant devices.
Current developments
Most literature on responsive surfaces for biological applications focuses on flat, 2D surfaces that respond to one type of stimulus which is externally provided. These surfaces have already shown great promise in the dynamic control of cell behavior; however, they are still far removed from the complex interactions that take place between cells and the ECM. In biology, several stimuli interact with both the cell and the ECM in a dynamic and interdependent manner within a complex 3D structure. Some progress has been made to incorporate some of these aspects in an artificial interface, as well; these advances will be reviewed here and discussed in context of the design of a new generation of biointerfaces.
Multistimuli-responsive materials
The responsive surfaces discussed above have all been designed to respond to one stimulus and provide one predetermined response. Natural cellular interactions with their environment are much more complex, using a multitude of stimuli and responsive mechanisms. Simplification and isolation of single responses enabled us to design surfaces that mimic these interactions on a rudimentary level; however, it does ignore any potential synergistic effects that arise from the multiresponsive nature of cell–ECM interactions. To advance artificial cell–material interactions, it will be necessary to design multistimuli-responsive surfaces [5].
The concept of multistimuli-responsive materials is emerging as one of the coming challenges for the responsive materials community. A recent review discussed progress toward multiresponsive polymers and highlights a number of multiresponsive systems that have been reported over the last decade [133]. These materials typically comprise block- or co-polymers of two or more different monomers that display responsiveness to different stimuli. Notably, it is possible to design multiresponsive surfaces that convert the input signal (inal stimulus) to a meaningful output signal. A triple stimuli-responsive random co-polymer based on pH sensve N,N-dimethylaminopropyl acrylamide (DMAPAM), temperature responsive N-t-butylacrylamide (NTBAM) and solvent polarity sensve 4-N-(2-acryloyloxyethyl)-N-methylamino-7-N,N-dimethylaminosulfonyl-2,1,3-benzoxadiazole (DBD-AE) showed a change in fluorescence (light response) due to a pH and temperature-induced alteration of the polarity of the co-polymer [134].
Multiple stimuli-responsive polymers should, in principle, be transferrable onto a solid substrate to prepare multistimuli-responsive surfaces. Only few such surfaces have been reported. Dual stimuli-responsive surfaces have been prepared as co-polymers of NIPAM (temperature responsive) and acrylic acid or methacrylic acid (pH responsive) via surface inated polymerizations [115,116]. The materials were characterized in terms of wettability [115] and swelling characteristics [116], displaying changes in these properties in response to either temperature or pH. Biological applications of such materials remain to be demonstrated.
There is a clear application potential for surfaces that respond to multiple stimuli in a biological surrounding to explore synergistic effects of the interaction with a more complex system. In addon, it would also be attractive to design materials with multiple responses to mimic the versatility of the ECM more closely. Multiresponsive surfaces that respond to multiple stimuli orthogonally, for example, producing two different responses to two different stimuli, would bring us significantly closer to approaching more complex cell–material interactions.
Responsive surfaces of 3D materials
The term ‘surfaces of 3D materials’ includes both the surfaces of materials with topographical features and the internal surfaces of porous, 3D objects. Both represent significant challenges in terms of surface modification and characterization but are of interest as materials for regenerative medicine because they provide environments that, to a degree, mimic structural features present in the ECM in addon to presenting biologically relevant chemical cues.
Probably, the most widely used responsive 3D materials are hydrogels, whose stimuli-responsive degradation has been exploited to modulate network structure [71] and elasticity [135] and the presentation of chemical functionales [135] which consequently enabled control over cellular responses such cell migration [71] and differentiation [135]. As these are bulk material responses, we will not discuss them here in detail.
Solid 3D scaffolds are widely used as supports for tissue engineering applications. Modification of the internal surface of such 3D structures is attractive to create responsive 3D structures that simultaneously simulate the chemical and structural dynamics of the ECM [136]. A step toward this is the release of bacterial inclusion bodies through biodegradation in polymer matrices made from poly(caprolactone), poly(lactic acid) or chitosan [137]. Even though this example relies on degradation and thus may not fully fit with the specific stimuli/response interactions of materials discussed here, it highlights the possibility of addressing the responsiveness of surfaces in porous 3D materials.
While a variety of surface modification approaches for 3D materials exist [138–140], uniform surface modification of internal 3D structures is not straightforward and compounded by limitations regarding the analysis of the surfaces of complex 3D structures. This makes the preparation of responsive 3D surfaces challenging. Recent advances in label-free, chemical 3D analysis [141,142] may address some of these issues and we anticipate that the emergence of methods capable of characterizing internal surfaces of 3D structures will contribute significantly to the development of strategies that enable the design of responsive surfaces on 3D structures.
Interactive biointerfaces
To fully integrate man-made materials in a biological environment, materials are required that do not only provide biologically relevant cues, but that are able to respond to biological stimuli presented by the cells. In recent literature, the vision of interactive and more complex cell–material interfaces, in other words, surfaces that dynamically respond to biological stimuli in a biologically relevant manner, has begun to emerge [6,13] and a few systems have been designed that address certain challenges toward the design of interactive biointerfaces.
In an attempt to expand responsive interfaces to a more dynamic, biology-based system, bacteria have been used to modify material surfaces and generate what the authors termed a ‘living interface’ as an intermediate between mammalian cells and the material surface. The nonpathogenic bacterium Lactococcus lactis has been genetically modified to express the RGD containing fibronectin fragment FNIII7–10 [143] and thus affect the adhesion and morphology of C2C12 cells [144]. While the bacteria-modified surface was not shown to be directly cell responsive, one can envision that the bacteria film would be responsive to changes in the biological environment and may be able to respond to changes in its surroundings that are brought about by the mammalian cells culture on the surface.
Cell responsiveness of a surface to a stimulus provided by a cell has been accomplished by employing the formation of metabolic products as trigger event. Lactoccocus lactis produces lactic acid which changes the pH of its surrounding and is thus able to affect changes in a pH responsive surface [122]. pH-induced expansion of a triblock co-polymer of polybutadiene, poly(methacrylic acid) and quaternized poly(2-(dimethylamino)ethyl methacrylate) consequently resulted in the self-induced detachment of the bacteria from the surface.
A more targeted cell-induced surface response can be accomplished with cell-secreted enzymes as stimuli. This possibility was recently explored with a peptide surface able to act as a substrate for alkaline phosphatase [74]. An RGD sequence flanked by phosphorylated serine and tyrosine residues was shown to be responsive to enzymatic dephosphorylation by alkaline phosphatase. The culture of mesenchymal stem cells on these surfaces indicated that cell-secreted alkaline phosphatase may be able to induce dephosphorylation without the need to add other external stimuli, promoting the concept of a cell-responsive material surface.
Another emerging aspect of cell–material interaction is the interface with internal cellular processes. Cell invasive techniques are well established to measure properties such as membrane potentials [145]. The measurement of intracellular parameters, for example, by perforating the cell membrane with carbon nanotube based electrochemical sensors [146], is increasingly attracting attention. It has been shown that nanometer-sized electrodes can be seamlessly integrated into the cell membrane [147]. Consequently, hollow tubes (?100 nm diameter) were fabricated on surfaces and connected to a liquid reservoir [148]. 这些管子被插入 HeLa 和中国仓鼠卵巢细胞,结果表明荧光染料可以直接输送到细胞间隙。结合细胞内传感和细胞内材料传递,可以设想在不久的将来可能会出现一种组合系统,该系统可以实现细胞内细胞-材料界面。
交互式生物界面在推进再生医学方面具有巨大潜力。更多动态组织培养平台将允许更好地控制体外细胞培养,使制造具有更高复杂性和功能的更复杂的人造组织成为可能。细胞响应表面可用于监测生物过程,以设计传感器或更好地了解细胞如何与其环境和/或彼此相互作用。植入物上的动态响应表面可以更wu缝地集成到宿主组织中,不仅可以指导生物环境,还可以响应宿主组织的要求。在各个方面都取得了有希望的进展,很可能使这项技术在不久的将来成为再生医学的强大工具,但在设计出真正可行的交互式生物界面之前,必须解决许多挑战。
结论和未来展望
旨在与生物环境交互的高级响应表面的zui终目标必须是提高人造材料与活细胞的整合水平。这种集成的性质可以采用多种形式,并将取决于生物接口设计的zui终应用。虽然模仿生物学中存在的复杂和动态的相互作用,即使是部分的,对于目前的技术来说似乎是一项艰巨的任务,但它也提供了大量令人兴奋的机会。
为响应式界面识别适当的刺激至关重要,因为它决定了有关材料特性及其设计的后续考虑因素。已经探索了能够改变与生物学相关的材料表面特性的多种刺激和材料响应。更频繁使用的刺激,如光、电势、温度和 pH 值已被证明对外部控制生物界面很有价值。
为了将生物界面与生物环境更紧密地结合起来,使用生物分子将非常有利,因为它们直接参与细胞过程的调节,因此可以用作调节细胞表面相互作用的标记物和触发器。特别是,酶作为物质反应的刺激物的使用正在迅速增加,并且随着对酶在生物过程和疾病状态中的相关性的了解的增加,利用酶的催化特性作为物质表面和细胞之间的信使可能会变得有帮助在设计更wu缝集成的生物界面方面。一个重要的先决条件是详细了解刺激酶在生物环境中的自然作用。
如果要将细胞-材料相互作用转化为具有生物学意义的反应和适用于实际生物医学应用的响应性生物界面,那么对生物刺激作出反应的表面设计将需要更多关注。因此,有必要将为散装材料开发的响应材料技术转化和扩展到生物界面。需要新的材料表面改性,不仅要对生物分子(或其他刺激)做出反应,还要将这种反应转化为表面或散装材料特性的可测量或功能变化。
迄今为止,只有有限数量的材料被用于制备生物应用的响应表面,因此可能限制了迄今为止观察到的细胞响应类型。由于生物分子可能成为刺激响应生物界面设计的核心,因此可以预期,基于生物分子的表面由于其多功能性和与生物刺激相互作用的能力,在未来可能会引起越来越多的兴趣。
由于许多生物相互作用是可逆的,可逆响应生物界面的设计可以很好地利用类似的概念,例如,通过利用酶催化双向反应的能力,或利用两种不同的酶催化生物分子的相反反应。相同的基材。zui终,这一概念可能会导致可逆生物界面的产生,其中一个或两个方向的变化可以依赖于燃料,例如,它们仅在其他辅因子存在的情况下发生。这种生物界面将代表朝着模仿生物过程的自然复杂性和多样性迈出的重要一步。
These advances can ultimately be envisioned to lead to the generation of more seamless cell–material interfaces, in which cells not only respond to cues from the surface, but where surfaces also respond to stimuli presented by cells. Such interactive biointerfaces would be highly attractive for self-controlled or autonomous biointerfaces and would open up excng application potentials to recreate more complex cell niches in which, for example, stem cell fate can be controlled in an unprecedented temporal and spatial manner or where nerve cells can be interfaced more seamlessly with an artificial material.
For practical reasons, most biointerfaces have thus far been designed on ‘flat’ substrates and with the ability to respond to a single, externally provided stimulus. To mimic the complexity of a biological system, response to several stimuli, including those provided by a cell and modification of surfaces of 3D objects will be desirable, and strategies have begun to emerge to address these challenges.
The recent emergence of technologies that allow access to the intracellular environment opens up excng opportunes to interface with cells on a whole new level. While tradonally cell–material interfaces proceeded from the surface through a protein layer and the integrins to the cytoleton and thus affect intracellular processes, direct interactions between the material and the intracellular environment will present new ways to control cell behavior and provide access to information about intracellular processes.
A major challenge in the design of such complex and dynamic biointerfaces is their monitoring and analysis. Advances in this area will heavily rely on the accessibility of suitable analysis tools that enable monitoring of the cell–material interface with high spatial and temporal resolution in a complex surrounding, ideally in the presence of live cells. While recent advances in surface and interface analysis such as the increasingly powerful capability to perform label-free 3D surface analysis of organic materials addresses parts of this challenge, further development will be necessary to access dynamic changes at the biointerface with minimal perturbance of the system.
The recent advances in the literature discussed here clearly show that the design of responsive interfaces is gaining impetus. Literature on the design of responsive bulk materials is already extensive and responsive surfaces are on the way to develop a similar toolset. Based on the considerable potential and interest in the area, we are likely to see a number of excng developments in the near future that will advance the integration of artificial materials with cells considerably and open up a large number of new applications.
Wettability |
| |
Detachment of peptide sequence |
| |
Attachment of peptide sequence |
| |
Reversible binding of peptide sequence |
| [87] |
Unblocking of peptide sequence |
| [72] |
Reversible display of peptide sequence through self assembly – leucine zipper domains |
| |
Reversible display of peptide sequence through self assembly – cyclodextrins |
| |
Reversible display of peptide sequence through conformational changes |
| |
聚合物结合电ji——调节谷氨酸 |
| [ 126 ] |
通过应力调节的表面孔隙率可逆地利用酶 |
| [ 121 ] |
地形特征的生成 |
| |
地形特征的重新定位 |
| |
图案形状的变化 |
| [ 89 ] |
同时改变表面形貌和刚度 |
|



























